大量研究证明,粒径小于5 mm的微塑料在海洋中普遍存在,且由于其粒径小,可被浮游动物、贝类、鱼类、海鸟和哺乳动物等海洋生物摄食并随食物链迁移。自2004年Thompson等[1]首次提出“微塑料”概念以来,微塑料研究快速发展,据统计已有2 000余名研究人员发表了600余篇微塑料研究论文[2]。作为微塑料研究中最为基础的环节,各种环境介质中微塑料的分析检测技术成为一个重要的研究方向并得到了长足发展[3-6]。但是,由于缺乏标准化分析操作方案,导致海洋环境中微塑料浓度、成分的可靠数据匮乏,不同研究间的结果不可比[3, 4, 7-9],甚至不确定[4, 10]。
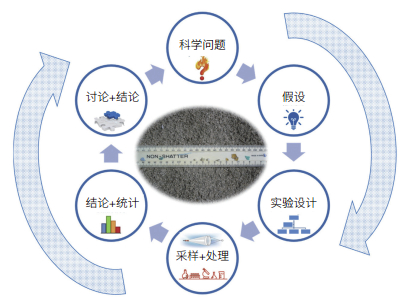
目前,国际上对海洋塑料污染问题的关注逐渐从科学研究层面向实质性污染管控和全球治理延伸,海洋塑料污染问题已从单一的环境问题演变为环境问题、经济问题和政治问题纵横交织的复杂问题[11]。在联合国《2030年可持续发展议程》的可持续发展目标(SDGs)框架内,减少塑料垃圾的数量是防治海洋“污染”的重要指标。调查研究海洋环境中微塑料,其目的是向社会公众和决策者揭示微塑料的污染程度,并为给出解决方案提供基础数据和技术支撑(图 1)。微塑料分析方法的不统一,不仅制约了相关科学问题的回答,也阻碍了塑料污染海洋治理的进程。本文综述了海洋环境中微塑料的采样、预处理、定量分析和定性鉴别等方面的进展,分析了微塑料分析方法发展所面临的挑战,以期为我国标准化微塑料分析方法的建立提供参考。
1 微塑料分析方法的发展现状 1.1 不同环境介质中微塑料样品的采集 1.1.1 海水为使采集的样品具代表性,通常需采集大体积海水样品。开放水体的微塑料样品通常采用不同网目的浮游生物网采集(图 2)。海表漂浮微塑料采用Manta网或Neuston网采集。Neuston双体船(图 2a)可在风浪较大时使用;Manta网(图 2b)最好在风平浪静水域使用,以防采样设备在波浪作用下跳动造成损坏[3],或避免由于设备状态不稳定造成采集水样体积不精准。拖网通常以约2节的速度拖曳15—30分钟。网目决定拖网内截留的颗粒物粒径及过滤的水样体积,已报道的网目在50—3 000 μm[13]。常用网目孔径约300 μm,其优势是能采集大体积水样,但不能定量采集 < 300 μm的颗粒物,特别是对具有生物学意义的 < 100 μm颗粒的代表性是严重不足的。小孔径网目被堵塞风险高,使用网目 < 300 μm拖网的研究较少。网衣尺寸也会影响过滤水样体积,通常网衣长3—4.5 m。此外,也有研究采用大体积样品的过滤采样[14, 15]、原位过滤采样[16]。不同的拖网类型、网目尺寸、滤膜孔径等非标准化采样操作,以及表征单位不统一等,严重阻碍了中上层水体中微塑料浓度的可比性。

|
| 图 2 常用的海表微塑料拖网 (a)Neuston双体船拖网; (b)Manta拖网; (c)Neuston拖网;(d)Bongo拖网 |
海滩微塑料调查通常布设数个垂直或平行于海岸线的样带,或布设正方形样方采样,通常将数个样品合并,综合评估目标海滩的微塑料污染。样品采集量通常为数百克到数千克不等[13]。采样位置的确定目前尚无定论,因为微塑料的分布与海滩的高、低潮线一样是动态的,废弃物聚集的高潮线是主要的采集区域[17]。一般采样深度为表层2.5 cm、3 cm或5 cm不等,但也有文献报道深达0.3 m[18, 19]。若使用柱状采样器,可实现不同深度的采样,并可确定不同年代的微塑料浓度。不同的研究给出的微塑料浓度单位也各不相同,包括单位采样面积、单位沉积物重量或体积的微塑料浓度。目前尚无海滩微塑料采样标准方案,所产生的数据可比性也不高。欧盟海洋垃圾技术小组(TSML)和美国大气与海洋局(NOAA)在海滩微塑料采集标准化方面有了一定的进展。
潮下带沉积物用抓斗取样器、箱式或柱状采样器(包括多管柱状采样器)采集,抓斗采样器会扰乱沉积物,适用于表层(5 cm)沉积物或大体积采样,而箱式或柱状采样器不会对样品产生干扰,可同时采集表面和不同层次的样品,但采样量少。沉积物样品一般冷冻或干燥后置于暗处储存,待进一步分析。
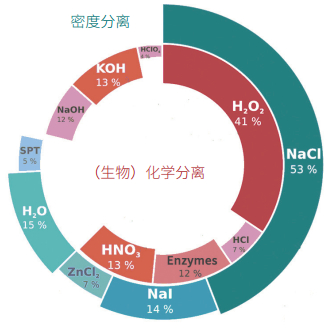
1.2 样品预处理由于环境样品中通常含有机质、藻类、木制品等各种干扰杂质,一般无法对微塑料样品直接进行分析,需要对样品进行分离提取,即密度分离和生物化学分离(消化)(图 3)[9, 20-24]。对于不同环境介质中的微塑料,采用的预处理方法有所不同(表 1)。值得推荐的是欧盟于2013年[25]及2015年[9, 26-29]制定的《欧洲海域海洋垃圾监测指南》(Guidance on monitoring of marine litter in European seas)中的预处理步骤。
一般塑料聚合物密度为0.8(如硅胶)—1.4 g cm−3(如聚对苯二甲酸乙二醇酯PET、聚氯乙烯PVC),而泡沫塑料——发泡聚苯乙烯(EPS)的密度(< 0.05 g cm−3)则很小。使用高密度的饱和盐溶液,可将微塑料颗粒从较高密度的基质,如沉积物(2.65 g cm−3)中浮选出来。使用的盐溶液密度越大,可提取的聚合物种类越多。NaCl价廉易得且环保,饱和NaCl溶液是常用的密度浮选液[1, 14, 18, 30],但其密度(~1.3 g cm−3)相对较低,PVC、PET、聚碳酸酯(PC)和聚氨酯(PU)等常见的聚合物不能全部被提取。饱和ZnCl2和NaI溶液密度较大[31],分别为1.4 —1.6 g cm−3 [31-33]和1.6—1.8 g cm−3 [31, 34],能提高提取高密度塑料组分的效率,因此有建议采用饱和NaI或ZnCl2溶液对微塑料进行分离浮选。回收率一般可达80%—100%[35],但对粒径较小的微塑料回收率不高[32],多次回收可提高回收率。使用商业化的“微塑料沉积物分离器”(MPSS),回收率可达68%—99%[34]、96%—100%[32]和98%—100%[36]。
提取和净化的目的是在去除如生物膜、沙子、木材、海洋生物及其残骸等非塑料物质的同时留存微塑料,并避免人为次生微塑料的产生。因此,不建议采用超声清洗[37],老化和变脆塑料可能在超声处理中断裂,人为生成新的次生微塑料。30% H2O2处理是较为推荐的微塑料净化方法[2]。此外,常用酸[38, 39]、碱[40-42]或酶溶液[43]去除污染物(图 3)。但聚酰胺、聚甲醛、聚碳酸酯等会与强酸或强碱发生反应[33, 36],限制了强酸或强碱的适用性。连续酶消解净化方法具有良好的应用前景,有研究者成功使用多种酶(如脂肪酶、淀粉酶、蛋白酶、几丁质酶、纤维素酶等)净化样品[3],被认为是在傅里叶变换红外光谱法(FTIR)鉴别分析前干扰较小的方法。
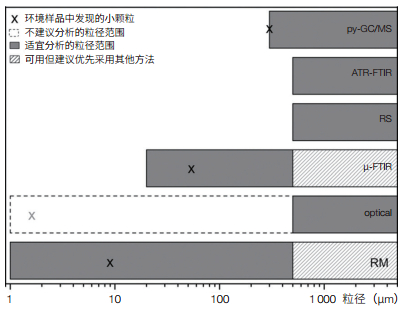
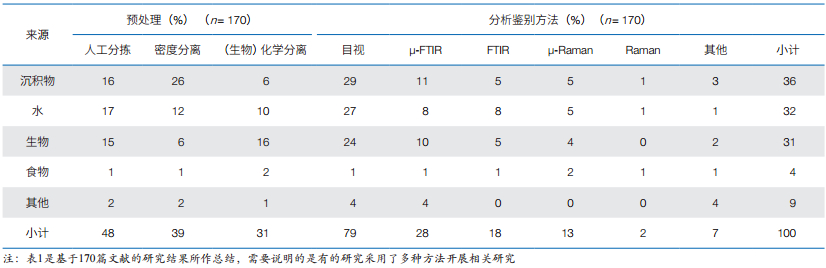
1.3 分析鉴别 1.3.1 目视鉴别尽管采用目视法对微塑料进行鉴别存在一定争议[9, 10, 13],但由于其具有操作简单、成本低和无化学危害等优点,是目前最常用的微塑料鉴别技术(占所有研究的79%)[25](表 1)。目视鉴别是用肉眼直接或在解剖显微镜下完成,适合粒径≥ 500 µm的微塑料鉴别[4, 25](图 4)。此外,扫描电镜可鉴别更小的碎片[44, 45],并获得更详实的样品表面信息,但操作复杂和耗时,实用性并不高。
虽然50%的目视鉴别是以缩小潜在微塑料范围为目的,尔后将采用仪器作进一步的鉴别[9, 46, 47],但另外50%的研究将目视法作为独立的鉴别方法[49, 50]。为避免主观或人为误判,已有人建立微塑料的目视检测操作程序[13, 25, 50, 51],但仅在1/4的研究论文中提及了该操作程序。若按操作程序检测,粒径≥ 500 µm微塑料的目视鉴别结果是可接受;而 < 500 μm的颗粒的误判概率非常高,不应使用目视鉴别法。据报道,目视鉴别的误差率变化范围为20%[52]—70%[13],并随着粒径的减小而有所增加。因此,目视鉴别由于其在精确度和聚合物类型测定方面的限制,不建议作为独立的鉴别方法,它只能是进一步分析鉴别的辅助工具。
1.3.2 傅里叶变换红外光谱法傅里叶变换红外光谱法(FTIR)是当前鉴定微塑料的最佳技术之一,可通过塑料颗粒的特征光谱获得具体的聚合物信息[13]。粒径≥ 300 μm的大颗粒可采用常规FTIR“衰减全反射”(ATR)模式进行检测,1 min内即可完成分析且精度高;而对于20—300 μm范围内的较小颗粒,可采用显微傅里叶变换红外光谱法(µ-FTIR)进行分析,µ-FTIR是目前最常用的微塑料鉴别仪器方法。观测方式主要有2种,即:随机或主观选择碎片的光谱观察[9, 22, 23];可同时测量多个斑点的基于焦平面阵列(FPA)FTIR成像[20, 21, 24],通过组合FPA场实现对滤膜上所有微塑料的分析。在参数设置上,最为常见的光谱分辨率为8 cm−1,空间分辨率50—150 µm。此外,通过FTIR光谱可以检测塑料颗粒的氧化程度,获取样品的物理化学风化信息,来准确识别风化严重的微塑料[53]。FTIR的优点是能够准确识别塑料类型,不受荧光干扰,还可对滤膜进行自动分析。但目前FTIR能识别的最小粒径为20 μm,不能检测环境中更小的塑料颗粒;此外,对于不透明/黑色的微塑料分析十分困难;样品中的水分会干扰鉴定,要求观察的样品必须彻底干燥处理。
记录光谱数据,然后评估鉴别结果,这是微塑料分析中最为关键的一个步骤。有2种常用评估方法:基于参比表格相关振动谱带的人工解译[54, 55]和与参比谱库完整谱图[56-59]进行比较的库检索。人工解译费时且需专业知识,仅适用于少量样品的分析。大多数FTIR商用软件可实现与参比谱库比较的库检索功能,有多种不同的算法计算命中质量指数(HQI),基于HQI接受或拒绝鉴别结果[57, 60],定量确定测量样本与参比谱图的相似性。
1.3.3 拉曼光谱法塑料聚合物具有特征拉曼光谱,可通过与参比谱库比较鉴别聚合物成分。该法可靠性高,近2年来显微拉曼光谱法已成功应用于不同环境样品中微塑料的鉴别。比较拉曼和红外这两种光谱方法,有研究者认为对于非常小的碎片(粒径≤ 20 µm)特别推荐拉曼光谱法[61]。在参数设置上,最常见的是532 nm[61, 62]和785 nm [63, 64]激光波长,拉曼位移范围变化很大,从200±150到3 000±1 000 cm[2]不等。观测方式有人工选点和光谱成像,但有研究者指出拉曼光谱成像耗时长(可高达38 h)[61],其实用性由此受到限制[2]。拉曼光谱也可以与激光扫描共聚焦显微镜耦合,在生物组织内定位聚合物颗粒,具有亚细胞精度[65]。与FTIR类似,库检索是一种较为适宜的评估工具。
环境样品中的色素、添加剂或污染物可能会产生荧光,如藻类[61],荧光干扰时不能生成可解译的拉曼光谱,因此拉曼法不能检测有荧光的样品。此外,激光诱导产生的荧光[7, 47, 61]也是干扰因素,一般而言较低的激发波长,传输的能量高,产生的信号强,但也会产生高强度的荧光,使用较高的激发波长(> 1 000 nm)可最小化荧光从而降低干扰。但同时激光器的能量较低会导致产生的聚合物样品信号较低[4]。在微塑料鉴别分析中,需要综合权衡荧光抑制和低信号强度,并发现最佳激发波长。
FTIR和拉曼光谱法是互补的技术,拉曼非活性的分子振动是红外(IR)的活性状态,反之亦然,因此这2种光谱法可提供关于微塑料样品的互补信息。
1.3.4 热分析方法除了目视鉴别、FTIR和拉曼光谱法外,有研究者采用热分析方法鉴别微塑料,其中值得注意的是气相色谱/质谱(GC/MS)及其所配附件,如:热裂解(py)附件或萃取-热脱附(TED)附件。
塑料聚合物热裂解生成特征热解图谱,py-GC/MS可分析微塑料的化学成分[35]。有研究采用py-GC/MS同时分析了PE、PP、PS、PA、PVC、PMMA等,并将自制的热解图谱库与商业谱库进行了比较[29, 66],但py-GC/MS法存在误判风险,因为不同的聚合物可能产生相似的热解产物。py-GC/MS的另一个缺点是允许上机的样品量小,仅0.5 mg,不适用于对异质或复杂样品的研究,如土壤、沉积物或生物样等[67]。每次只能分析1个颗粒,不能应用于大规模采样和常规监测工作中处理大批量样品。与py-GC/MS相比,TED-GC/MS可处理的样品量达100 mg,其鉴别结果不受加热引起的降解影响[67],该法稳定且适用于环境样品分析,但其实用性需要进一步的研究和验证。
热分析方法与光谱方法存在很大不同。光谱法不会对样品造成损坏,它们通过激发特定官能团的振动来表征样品的信息,但是处理过程耗时较长。py-GC/MS和TED-GC/MS则通过待测样品加热后的分解产物来鉴别微塑料成分,可以同时识别聚合物类型和添加剂。光谱法与光学显微镜耦合,显微红外和显微拉曼还可得到颗粒的大小和数量信息。但py-GC/MS和TED-GC/MS法只能得出聚合物的总质量分数,不能得到微塑料的数量和粒径分布的信息。
2 微塑料分析方法发展面临的挑战分析 2.1 环境样品的采样代表性问题海洋环境要素呈不同时间尺度的周期性变化(如潮汐、季节和厄尔尼诺等),或沿生态梯度呈不同空间尺度的变化(如河口、水深和温跃层等),在采样设计时需考虑上述时空变化[12]。但目前微塑料采样很少考虑环境要素的季节变化[68, 69]或年际变化,也未考虑小尺度的时空(小时、天;米)变化。比如,海水中微塑料的垂直分布存在随深度指数衰减的情况,仅基于表层拖网的评估,可能低估海洋中塑料的真实存量;微塑料夜间采样会受到浮游动物向表层垂直迁移的影响,导致网获到大量浮游动物、仔鱼等海洋生物,增加了实验室前处理的困难;采用化学前处理,理论上分析结果是水体和生物体内微塑料的总量,增加了调查结果的不确定性。此外,降雨、风浪等物理过程对海表微塑料的分布影响也较大。
由于研究目标不同,采用的方法和技术不同,以及数据上报的单位不同等,导致数据的质量和分辨率均不同,影响了数据的可靠性和可比性,也很难将不同时空采集的样品进行比较[70]。因此,多方倡导建立涵盖从采样、样品预处理到鉴别的海洋环境样品中微塑料分析检测全流程的标准化作业程序(SOPs)。加强采样设计的代表性研究,特别是海滩上采集的沉积物样品。虽然海滩采样本身不具挑战,但要选择适当的采样位置,有代表性地描述动态变化的海滩的塑料污染确实具有挑战性。TSML[25]建议欧盟成员国首先标准化微塑料监测计划中的海滩采样方法。
2.2 自动化鉴别技术的应用问题尽管显微技术的应用(如µ-FTIR、µ-Raman)在微塑料鉴别中占越来越主导的地位,但针对大批量样品的分析存在两方面的挑战:①如何测定所有的颗粒;②如何评估所有的谱图。使用FPA检测器,允许多点同时测量,但同时也会产生大量的谱图,难以处理。使用荧光技术,可预先智能自动选择感兴趣的测点来减少工作量[71]。此外,也有全自动的商业软件解决方案,如用于µ-Raman测定的HORIBA ParticleFinder软件[72],实现颗粒物的自动检测,可在3 h内分析一个海水样品中70%以上的微塑料。但即便如此,在多数情况下光谱分析的工作量也非常高,迫切需要开发强大的自动化微塑料鉴别评估工具。尽管已定义了HQI的阈值,但即使较高的HQI,也可能导致错误分类[24, 73]。因此,有必要开发更强大的库检索算法,并能处理微塑料的风化问题,可将其与参比原始聚合物进行比较。
2.3 空气中纤维的沾污问题研究发现空气纤维的背景浓度达到了显著水平,在实验室空白和环境样品中发现了相似数量的微纤维[15, 48]。目前的大多研究为避免沾污,用金属箔片覆盖样品和仪器[15, 74]。在实验结果中扣除实验室分析空白或从分析结果中直接剔除纤维,但若剔除纤维,则意味着研究中忽略了包括合成纤维在内的微纤维,使得纤维成了研究盲点。空气中纤维沾污的相关研究比较少,亟待加强。
2.4 纳米微塑料的分析问题随着风化塑料碎片越来越小,纳米塑料的分析就成为必须解决的问题。关于取样和预处理,可借鉴金属纳米颗粒方法。但分析则成为一个难题,关键的问题在于如何从天然非塑料纳米颗粒中区分合成纳米塑料。有研究者尝试采用红外原子力显微镜(AFM-IR)[75]进行纳米塑料的分析,但是由于纳米塑料比微塑料更具异质性,该系统的适用性尚未得到有效证实[2]。在海水或土壤等真实环境样品中,开展纳米塑料的检测研究相当少,与此相反的是生物摄食纳米塑料的毒性研究和模型研究正在激增。然而,模拟研究加入的是受控合成荧光纳米塑料,用透射电镜(TEM)即可检测,但TEM检测是不能提供化学结构的任何信息的,当然模拟研究也不需要结构信息。在纳米粒子追踪分析(NTA)模型研究中证明了次生纳米塑料的生成,虽然无法确定纳米塑料的化学结构,但发现纳米粒子浓度可高达1.26×108个/mL,比空白对照高3倍[76]。从浓度量级来看,微塑料可使用的“逐个粒子”分析方法,对纳米塑料而言是不可能实现的目标。
众所周知,纳米塑料产自大量的中型塑料和微塑料塑料,并且可被生物吸收。迄今,尚不知道如何检测真实环境样品中的纳米塑料,因为难以将它们与没有化学结构信息的天然纳米颗粒区分开。因此,开发真正的纳米塑料分析方法,并打破基于简单计数统计的分析检测概念将是未来最大的挑战。
3 小结每年都会有不同的研究公布估测的目前海洋环境中微塑料的浓度和分布,而微塑料的量化仍存在诸多尚未解决的问题。标准化操作程序的缺乏加剧了这个问题,例如:一些研究采用目视法鉴别和计数微塑料;另外一些研究则进行物理/化学分离后计数微塑料;而其他研究则使用光谱进行鉴别。此外,微塑料在环境中分布不均匀,这几乎阻碍了代表性结论的得出。因此,不仅需要标准化微塑料的鉴别和量化方法,而且也需要解决取样代表性的问题。
在微塑料研究中,标准化的方法可获取有效的微塑料数据,包括浓度、粒径分布、聚合物组分,以及在不同的海洋栖息地和海洋生物群中微塑料的分布等;标准化的方法对于保证不同数据集的可比性至关重要。此外,所产生的数据将作为真实环境浓度下,微塑料对海洋生物影响的实验室试验设计的基础。因此,标准化对客观评价全球海洋中微塑料,并评估其潜在影响和风险至关重要。
| [1] |
Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea:where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI:10.1126/science.1094559 |
| [2] |
Renner G, Schmidt T C, Schram J. Analytical methodologies for monitoring micro(nano)plastics:Which are fit for purpose?[J]. Current Opinion in Environmental Science & Health, 2018, 1: 55-61. |
| [3] |
Löder M G J, Gerdts G. Methodology used for the detection and identification of microplastics-a critical appraisal//Bergmann M, Gutow L, Klages M, eds. Marine Anthropogenic Litter, Chapter 8. Springer International Publishing, 2015: 201-228.
|
| [4] |
Rocha-Santos T, Duarte A C. A critical overview of the analytical approaches to the occurrence, the fate and the behavior of microplastics in the environment[J]. TrAC Trends in Analytical Chemistry, 2015, 65: 47-53. DOI:10.1016/j.trac.2014.10.011 |
| [5] |
Besley A, Vijver M G, Behrens P, et al. A standardized method for sampling and extraction methods for quantifying microplastics in beach sand[J]. Marine Pollution Bulletin, 2017, 114(1): 77-83. DOI:10.1016/j.marpolbul.2016.08.055 |
| [6] |
Coppock R L, Cole M, Lindeque P K, et al. A small-scale, portable method for extracting microplastics from marine sediments[J]. Environmental Pollution, 2017, 230: 829-837. DOI:10.1016/j.envpol.2017.07.017 |
| [7] |
Karami A, Golieskardi A, Keong C C, et al. The presence of microplastics in commercial salts from different countries[J]. Scientific Reports, 2017, 7: 46173. DOI:10.1038/srep46173 |
| [8] |
Filella M. Questions of size and numbers in environmental research on microplastics:methodological and conceptual aspects[J]. Environmental Chemistry, 2015, 12(5): 527-538. DOI:10.1071/EN15012 |
| [9] |
Song Y K, Hong S H, Jang M, et al. A comparison of microscopic and spectroscopic identification methods for analysis of microplastics in environmental samples[J]. Marine Pollution Bulletin, 2015, 93(1): 202-209. |
| [10] |
Wesch C, Barthel A-K, Braun U, et al. No microplastics in benthic eelpout (Zoarces viviparus):an urgent need for spectroscopic analyses in microplastic detection[J]. Environmental Research, 2016, 148: 36-38. DOI:10.1016/j.envres.2016.03.017 |
| [11] |
王菊英, 林新珍. 应对塑料及微塑料污染的海洋治理体系浅析[J]. 太平洋学报, 2018(4): 80-88. |
| [12] |
Costa M F, Costa J P D, Duarte A C. Sampling of micro(nano) plastics in environmental compartments:How to define standard procedures?[J]. Current Opinion in Environmental Science & Health, 2018, 1: 36-40. |
| [13] |
Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the marine environment:A review of the methods used for identification and quantification[J]. Environmental Science and Technology, 2012, 46(6): 3060-3075. DOI:10.1021/es2031505 |
| [14] |
Ng K L, Obbard J P. Prevalence of microplastics in Singapore's coastal marine environment[J]. Marine Pollution Bulletin, 2006, 52(7): 761-767. DOI:10.1016/j.marpolbul.2005.11.017 |
| [15] |
Dubaish F, Liebezeit G. Suspended microplastics and black carbon particles in the Jade system, Southern North Sea[J]. Water, Air, and Soil Pollution, 2013, 224(2): 1-8. |
| [16] |
Norén F, Naustvoll L J. Survey of microscopic anthropogenic particles in Skagerrak. TA 2779-2011. Norway: KLIMA-OG Forurensnings Direktoratet, 2010.
|
| [17] |
Browne M A, Galloway T S, Thompson R C. Spatial patterns of plastic debris along estuarine shorelines[J]. Environmental Science and Technology, 2010, 44(9): 3404-3409. DOI:10.1021/es903784e |
| [18] |
Claessens M, De Meester S, van Landuyt L, et al. Occurrence and distribution of microplastics in marine sediments along the Belgian coast[J]. Marine Pollution Bulletin, 2011, 62(10): 2199-2204. DOI:10.1016/j.marpolbul.2011.06.030 |
| [19] |
Van Cauwenberghe L, Vanreusel A, Mees J, et al. Microplastic pollution in deep-sea sediments[J]. Environmental Pollution, 2013, 182: 495-499. DOI:10.1016/j.envpol.2013.08.013 |
| [20] |
Käppler A, Windrich F, Löder M G, et al. Identification of microplastics by FTIR and Raman microscopy:a novel silicon filter substrate opens the important spectral range below 1300 cm-1 for FTIR transmission measurements[J]. Analytical and Bioanalytical Chemistry, 2015, 407(22): 6791-6801. DOI:10.1007/s00216-015-8850-8 |
| [21] |
Löder M G J, Kuczera M, Mintenig S, et al. Focal plane array detector-based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples[J]. Environmental Chemistry, 2015, 12(5): 563-581. DOI:10.1071/EN14205 |
| [22] |
Yang D, Shi H, Li L, et al. Microplastic pollution in table salts from China[J]. Environmental Science and Technology, 2015, 49(22): 13622-13627. DOI:10.1021/acs.est.5b03163 |
| [23] |
Comnea-Stancu I R, Wieland K, Ramer G, et al. On the identification of rayon/viscose as a major fraction of microplastics in the marine environment:discrimination between natural and manmade cellulosic fibers using Fourier transform infrared spectroscopy[J]. Applied Spectroscopy, 2017, 71(5): 939-950. DOI:10.1177/0003702816660725 |
| [24] |
Primpke S, Lorenz C, Rascher-Friesenhausen R, et al. An automated approach for microplastics analysis using focal plane array (FPA) FTIR microscopy and image analysis[J]. Analytical Methods, 2017, 9(9): 1499-1511. DOI:10.1039/C6AY02476A |
| [25] |
MSFD-TSML. Guidance on monitoring of marine litter in European seas. Luxembourg: Publications Office of the European Union, 2013.
|
| [26] |
Wagner J, Wang Z-M, Ghosal S, et al. Novel method for the extraction and identification of microplastics in ocean trawl and fish gut matrices[J]. Analytical Methods, 2017, 9(9): 1479-1490. DOI:10.1039/C6AY02396G |
| [27] |
Karami A, Golieskardi A, Choo C K, et al. A high-performance protocol for extraction of microplastics in fish[J]. Science of the Total Environment, 2017, 578: 485-494. DOI:10.1016/j.scitotenv.2016.10.213 |
| [28] |
Crichton E M, Noel M, Gies E A, et al. A novel, density independent and FTIR-compatible approach for the rapid extraction of microplastics from aquatic sediments[J]. Analytical Methods, 2017, 9(9): 1419-1428. DOI:10.1039/C6AY02733D |
| [29] |
Dehaut A, Cassone A-L, Frere L, et al. Microplastics in seafood:benchmark protocol for their extraction and characterization[J]. Environmental Pollution, 2016, 215: 223-233. DOI:10.1016/j.envpol.2016.05.018 |
| [30] |
Browne M A, Crump P, Niven S J, et al. Accumulation of microplastic on shorelines worldwide:Sources and sinks[J]. Environmental Science and Technology, 2011, 45(21): 9175-9179. DOI:10.1021/es201811s |
| [31] |
Ivleva N P, Wiesheu A C, Niessner R. Microplastic in aquatic ecosystems[J]. Angewandte Chemie International Edition, 2017, 56(7): 1720-1739. DOI:10.1002/anie.201606957 |
| [32] |
Imhof H K, Schmid J, Niessner R, et al. A novel, highly efficient method for the separation and quantification of plastic particles in sediments of aquatic environments[J]. Limnology and OceanographyMethods, 2012, 10: 524-537. |
| [33] |
Liebezeit G, Dubaish F. Microplastics in beaches of the East Frisian Islands Spiekeroog and Kachelotplate[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(1): 213-217. DOI:10.1007/s00128-012-0642-7 |
| [34] |
Nuelle M T, Dekiff J H, Remy D, et al. A new analytical approach for monitoring microplastics in marine sediments[J]. Environmental Pollution, 2014, 184: 161-169. DOI:10.1016/j.envpol.2013.07.027 |
| [35] |
Fries E, Dekiff J H, Willmeyer J, et al. Identification of polymer types and additives in marine microplastic particles using pyrolysisGC/MS and scanning electron microscopy[J]. Environmental ScienceProcesse & Impacts, 2013, 15(10): 1949-1956. |
| [36] |
Claessens M, van Cauwenberghe L, Vandegehuchte M B, et al. New techniques for the detection of microplastics in sediments and field collected organisms[J]. Marine Pollution Bulletin, 2013, 70(1-2): 227-233. DOI:10.1016/j.marpolbul.2013.03.009 |
| [37] |
Cooper D A, Corcoran P L. Effects of mechanical and chemical processes on the degradation of plastic beach debris on the island of Kauai, Hawaii[J]. Marine Pollution Bulletin, 2010, 60(5): 650-654. DOI:10.1016/j.marpolbul.2009.12.026 |
| [38] |
Desforges J-P W, Galbraith M, Ross P S. Ingestion of microplastics by zooplankton in the northeast Pacific Ocean[J]. Archives of Environmental Contamination and Toxicology, 2015, 69(3): 320-330. DOI:10.1007/s00244-015-0172-5 |
| [39] |
Davidson K, Dudas S E. Microplastic ingestion by wild and cultured manila clams Venerupis philippinarum[J]. Archives of Environmental Contamination and Toxicology, 2016, 71(2): 147-156. DOI:10.1007/s00244-016-0286-4 |
| [40] |
Rochman C M, Tahir A, Williams S L, et al. Anthropogenic debris in seafood:plastic debris and fibers from textiles in fish and bivalves sold for human consumption[J]. Scientific Reports, 2015, 5: 14340. DOI:10.1038/srep14340 |
| [41] |
Kühn S, van Werven B, van Oyen A, et al. The use of potassium hydroxide (KOH) solution as a suitable approach to isolate plastics ingested by marine organisms[J]. Marine Pollution Bulletin, 2017, 115(1): 86-90. |
| [42] |
Roch S, Brinker A. Rapid and efficient method for the detection of microplastic in the gastrointestinal tract of fishes[J]. Environmental Science and Technology, 2017, 51(8): 4522-4530. DOI:10.1021/acs.est.7b00364 |
| [43] |
Zhao S, Zhu L, Li D. Microplastic in three urban estuaries, China[J]. Environmental Pollution, 2015, 206: 597-604. DOI:10.1016/j.envpol.2015.08.027 |
| [44] |
Anderson P J, Warrack S, Langen V, et al. Microplastic contamination in lake Winnipeg, Canada[J]. Environmental Pollution, 2017, 225: 223-231. DOI:10.1016/j.envpol.2017.02.072 |
| [45] |
Courtene-Jones W, Quinn B, Murphy F, et al. Optimisation of enzymatic digestion and validation of specimen preservation methods for the analysis of ingested microplastics[J]. Analytical Methods, 2017, 9(9): 1437-1445. DOI:10.1039/C6AY02343F |
| [46] |
Avio C G, Gorbi S, Regoli F. Experimental development of a new protocol for extraction and characterization of microplastics in fish tissues:first observations in commercial species from Adriatic Sea[J]. Marine Environmental Research, 2015, 111: 18-26. DOI:10.1016/j.marenvres.2015.06.014 |
| [47] |
Lenz R, Enders K, Stedmon C A, et al. A critical assessment of visual identification of marine microplastic using Raman spectroscopy for analysis improvement[J]. Marine Pollution Bulletin, 2015, 100(1): 82-91. DOI:10.1016/j.marpolbul.2015.09.026 |
| [48] |
Woodall L C, Gwinnett C, Packer M, et al. Using a forensic science approach to minimize environmental contamination and to identify microfibres in marine sediments[J]. Marine Pollution Bulletin, 2015, 95(1): 40-46. DOI:10.1016/j.marpolbul.2015.04.044 |
| [49] |
Peters C A, Bratton S P. Urbanization is a major influence on microplastic ingestion by sunfish in the Brazos River Basin, central Texas, USA[J]. Environmental Pollution, 2016, 210: 380-387. DOI:10.1016/j.envpol.2016.01.018 |
| [50] |
Dekiff J H, Remy D, Klasmeier J, et al. Occurrence and spatial distribution of microplastics in sediments from Norderney[J]. Environmental Pollution, 2014, 186: 248-256. DOI:10.1016/j.envpol.2013.11.019 |
| [51] |
Doyle M J, Watson W, Bowlin N M, et al. Plastic particles in coastal pelagic ecosystems of the northeast Pacific ocean[J]. Marine Environmental Research, 2011, 71(1): 41-52. DOI:10.1016/j.marenvres.2010.10.001 |
| [52] |
Eriksen M, Mason S, Wilson S, et al. Microplastic pollution in the surface waters of the Laurentian Great Lakes[J]. Marine Pollution Bulletin, 2013, 77(1-2): 177-182. DOI:10.1016/j.marpolbul.2013.10.007 |
| [53] |
ASTM International. ASTM D5576-00. Standard practice for determination of structural features in polyolefins and polyolefin copolymers by infrared spectrophotometry (FT-IR). West Conshohocken, PA: 2000.
|
| [54] |
Neves D, Sobral P, Ferreira J L, et al. Ingestion of microplastics by commercial fish off the Portuguese coast[J]. Marine Pollution Bulletin, 2015, 101(1): 119-126. DOI:10.1016/j.marpolbul.2015.11.008 |
| [55] |
Frias J, Gago J, Otero V, et al. Microplastics in coastal sediments from southern Portuguese shelf waters[J]. Marine Environmental Research, 2016, 114: 24-30. DOI:10.1016/j.marenvres.2015.12.006 |
| [56] |
Mani T, Hauk A, Walter U, et al. Microplastics profile along the Rhine river[J]. Scientific Reports, 2015, 5: 17988. |
| [57] |
Lusher A L, Hernandez-Milian G, O'Brien J, et al. Microplastic and macroplastic ingestion by a deep diving, oceanic cetacean:the true's beaked whale Mesoplodon mirus[J]. Environmental Pollution, 2015, 199: 185-191. DOI:10.1016/j.envpol.2015.01.023 |
| [58] |
Wang J, Peng J, Tan Z, et al. Microplastics in the surface sediments from the Beijiang River littoral zone:composition, abundance, surface textures and interaction with heavy metals[J]. Chemosphere, 2017, 171: 248-258. DOI:10.1016/j.chemosphere.2016.12.074 |
| [59] |
Watermann B, Löder M, Herlyn M, et al. Long-term 2007-2013 monitoring of reproductive disturbance in the dun sentinel Assiminea grayana with regard to polymeric materials pollution at the coast of Lower Saxony, North sea, Germany[J]. Environmental Science and Pollution Research International, 2017, 24(4): 3352-3362. DOI:10.1007/s11356-016-8058-2 |
| [60] |
Klein S, Worch E, Knepper T P. Occurrence and spatial distribution of microplastics in river shore sediments of the Rhine-Main area in Germany[J]. Environmental Science and Technology, 2015, 49(10): 6070-6076. DOI:10.1021/acs.est.5b00492 |
| [61] |
Käppler A, Fischer D, Oberbeckmann S, et al. Analysis of environmental microplastics by vibrational microspectroscopy:FTIR, Raman or both?[J]. Analytical and Bioanalytical Chemistry, 2016, 408(29): 8377-8391. DOI:10.1007/s00216-016-9956-3 |
| [62] |
Sruthy S, Ramasamy E. Microplastic pollution in Vembanad Lake, Kerala, India:the first report of microplastics in lake and estuarine sediments in India[J]. Environmental Pollution, 2017, 222: 315-322. DOI:10.1016/j.envpol.2016.12.038 |
| [63] |
Zhao S, Danley M, Ward J E, et al. An approach for extraction, characterization and quantitation of microplastic in natural marine snow using Raman microscopy[J]. Analytical Methods, 2017, 9(9): 1470-1478. DOI:10.1039/C6AY02302A |
| [64] |
Zhang K, Xiong X, Hu H, et al. Occurrence and characteristics of microplastic pollution in Xiangxi Bay of three gorges reservoir, China[J]. Environmental Science and Technology, 2017, 51(7): 3794-3801. DOI:10.1021/acs.est.7b00369 |
| [65] |
Cole M, Lindeque P, Fileman E, et al. Microplastic ingestion by zooplankton[J]. Environmental Science and Technology, 2013, 47(12): 6646-6655. DOI:10.1021/es400663f |
| [66] |
Fischer M, Scholz-Bottcher B M. Simultaneous trace identification and quantification of common types of microplastics in environmental samples by pyrolysis-gas chromatography-mass spectrometry[J]. Environmental Science and Technology, 2017, 51(9): 5052-5060. DOI:10.1021/acs.est.6b06362 |
| [67] |
Dümichen E, Barthel A K, Braun U, et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method[J]. Water Research, 2015, 85: 451-457. DOI:10.1016/j.watres.2015.09.002 |
| [68] |
Lima A R A, Barletta M, Costa M F. Seasonal distribution and interactions between plankton and microplastics in a tropical estuary[J]. Estuarine, Coastal and Shelf Science, 2015, 165: 213-225. DOI:10.1016/j.ecss.2015.05.018 |
| [69] |
Cole M. A novel method for preparing microplastic fibers[J]. Scientific Reports, 2016, 6: 34519. DOI:10.1038/srep34519 |
| [70] |
Underwood A J, Chapman M G, Browne M A, et al. Some problems and practicalities in design and interpretation of samples of microplastic waste[J]. Analytical Methods, 2017, 9: 1332-1345. DOI:10.1039/C6AY02641A |
| [71] |
Maes T, Jessop R, Wellner N, et al. A rapid-screening approach to detect and quantify microplastics based on fluorescent tagging with Nile red[J]. Scientific Reports, 2017, 7: 44501. DOI:10.1038/srep44501 |
| [72] |
Frère L, Paul-Pont I, Moreau J, et al. A semi-automated Raman micro-spectroscopy method for morphological and chemical characterizations of microplastic litter[J]. Marine Pollution Bulletin, 2016, 113(1): 461-468. |
| [73] |
Renner G, Schmidt T C, Schram J. Characterization and quantification of microplastics by infrared spectroscopy[J]. Comprehensive Analytical Chemistry, 2016, 75: 67-118. |
| [74] |
Foekema E M, De Gruijter C, Mergia M T, et al. Plastic in North sea fish[J]. Environmental Science and Technology, 2013, 47(15): 8818-8824. DOI:10.1021/es400931b |
| [75] |
Dazzi A, Prater C B, Hu Q, et al. AFM-IR:combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization[J]. Applied Spectroscopy, 2012, 66(12): 1365-1384. DOI:10.1366/12-06804 |
| [76] |
Lambert S, Wagner M. Characterisation of nanoplastics during the degradation of polystyrene[J]. Chemosphere, 2016, 145: 265-268. DOI:10.1016/j.chemosphere.2015.11.078 |