2. 复旦大学 公共卫生学院 上海 200032;
3. 山西大学 环境与资源学院 太原 030006
2. School of Public Health, Fudan University, Shanghai 200032, China;
3. College of Environment and Resource, Shanxi University, Taiyuan 030006, China
持久性有毒污染物(PTS)被认为是21世纪影响人类生存与健康的重要环境问题。PTS主要包括:持久性有机污染物(POPs),如多氯联苯(PCBs)、多环芳烃(PAHs)、多溴联苯醚(PBDE)、二噁英(Dioxins)等;以及有机金属化合物,如有机汞、有机锡和有机铅等[1, 2]。由于PTS在环境中难以降解,能够长距离迁移,并且具有生物累积效应和极大的毒性,会给人体健康和环境带来长期负面影响与危害。因此,PTS受到各国政府及环境科学家的持续重点关注,属于国际环境科学研究的前沿热门领域[3]。
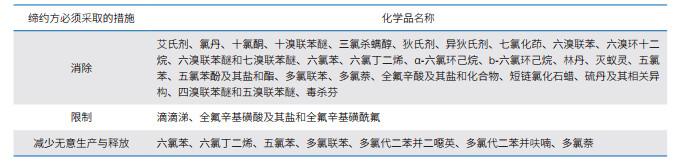
近几十年,国际环境保护经历了从常规大气和水污染治理、重金属污染控制到PTS的削减与控制的历程[4]。为控制PTS人为排放导致的生态环境问题,各国已达成多个全球性公约,如2001年签署的《关于持久性有机污染物的斯德哥尔摩公约》(以下简称《斯德哥尔摩公约》)、2013年签署的《关于汞的水俣公约》。以POPs为例,《斯德哥尔摩公约》要求监测与削减的种类已扩展至30种(表 1)①。近20年来,我国在POPs环境监测技术标准方面已跃居世界领先行列。然而,我国人体中POPs的存在水平、变化趋势及健康风险尚不明确[5]。未来,随着《斯德哥尔摩公约》中POPs种类的增多,认识我国环境和人体中POPs的变化趋势成为长期而艰巨的任务。
① All POPs listed in the Stockholm Convention. http://www.pops.int/TheConvention/ThePOPs/AllPOPs/tabid/2509/Default.aspx.
目前已知,大气、土壤、水体及沉积物等多类环境介质均会受到PTS不同程度的污染。PTS在环境中滞留时间长,可通过大气、水或食物链传播,具有极强的生物蓄积性,进而可以对人体产生多种负面影响,如癌症、内分泌紊乱、生殖发育障碍、神经系统损伤、心血管疾病等②。环境PTS的人体暴露途径主要包括:①从空气吸入挥发性或颗粒性PTS;②从污染饮用水中摄入PTS;③食用来源于PTS污染区域的农牧产品或水产品;④皮肤暴露接触PTS。长期以来,PTS的环境暴露与人体健康效应受到广泛地关注,全球科研工作者开展了大量研究证实其潜在的健康风险与危害。
② Persistent Organic Pollutants (POPs) and Pesticides. https://www.unenvironment.org/cep/persistent-organic-pollutants-pops-and-pesticides.
(1)致癌性。恶性肿瘤是严重威胁我国居民健康的一大类疾病。国家肿瘤质控中心发布的《 2019全国癌症报告》显示:近10多年来,我国恶性肿瘤发病率每年保持约3.9%的增幅,癌症负担呈持续上升态势,城乡恶性肿瘤发病水平差距逐渐缩小,这与人口老龄化、工业化和城镇化、生活方式、环境污染等因素紧密相关③。据估计,全球约16%的癌症死亡与环境风险因素有关[6]。其中,环境PTS暴露与乳腺癌、前列腺癌、结直肠癌、甲状腺癌等多种癌症的风险增加有关[7]。
③ 2019年全国癌症报告. http://www.china-rt.cn/special/846.html.
(2)内分泌干扰。绝大部分PTS属于内分泌干扰物,可作用于多类激素受体,进而干扰体内激素稳态[8]。相关研究表明,PTS与甲状腺激素稳态失衡及胰岛素抵抗之间存在显著关联,并可通过干扰物质和能量代谢过程、影响体脂分布等途径[9],增加甲状腺疾病[10]、肥胖[11]、糖尿病[12]和代谢综合征[13]等发生的风险。
(3)生育风险。 PTS可通过扰乱性激素水平,进而引起生殖系统发育受阻和生殖功能过早衰退。相关研究发现,PTS暴露与促卵泡激素、促黄体激素、总睾酮的升高[14],以及雌二醇和抗苗勒管激素的下降存在显著关联[15];并可导致女性原发性卵巢功能不全[16]、卵巢早衰[17],以及男性睾丸发育不全综合征等问题[18]。此外,PTS还可以通过胎盘从母体传递给后代,进而导致婴儿不良出生结局,如早产和低出生体重[19]。
(4)神经损伤。 PTS可以通过阻碍多巴胺神经传递、影响甲状腺激素和钙离子依赖信号传导、诱导氧化应激等多种途径导致神经系统损伤[20]。相关研究发现,儿童早期发育阶段的PTS暴露与神经发育迟缓[21]、自闭症障碍[22]、注意力缺陷和多动障碍[23]等神经系统发育异常有关。
(5)心血管疾病。 PTS主要通过激活芳香烃受体信号通路、增加氧化应激、激活核因子κB并介导炎症反应、损害肾素-血管紧张素系统调节功能等途径影响心血管系统[24]。相关研究发现,PTS暴露可显著改变循环系统的脂质水平[25],引起血清总胆固醇与低密度脂蛋白胆固醇增高[26],进而增加冠心病[27]、高血压[28]、脑卒中[29]、颈动脉粥样硬化[30]等风险。
2 领域现状与发展态势 2.1 国际现状(1)发展战略与研究计划。西方发达国家一直在国家层面部署环境与健康战略研究计划,并投入大量资金支持相应的基础和应用研究,以保障人群健康。例如,2003年欧盟委员会通过了《欧洲环境与健康发展战略》,试图针对环境与健康问题建立完整有效的政策与研究框架,降低环境因素造成的健康风险与疾病负担。2004年欧盟委员会通过了《欧洲环境与健康行动计划》,旨在加强各成员国在环境健康领域的合作,推动环境风险因素与疾病方面的研究。2007年美国国家研究咨询委员会发表了《 21世纪的毒性测试:展望与策略》,并推动了“Tox21”大科学工程合作研究的启动。通过科学导向,自上而下地开展系统的“毒性通路”研究,以发现新的分子生物学终点、揭示毒性作用模式。美国国家环境健康科学研究所(NIEHS)的全美毒理学计划(NTP)、美国国家环境保护局(EPA)、国家转化科学发展中心(NCATS)和美国食品药品监督局(FDA)已相继加入“Tox21”行动计划。该计划主要面向商业化学品、农药、污染物等领域开展研究,包括基础研究、暴露研究、转化科学、健康差别与全球环境健康、培训与教育、交流与参与等6个主题,以及知识管理合作与集成方法2个交叉研究主题。
(2)基础研究。在科学研究方面,国际环境健康研究正在向低剂量暴露转移,通过揭示氧化应激、炎症、基因损伤、表观遗传改变等机体响应的分子机制和信号通路,以期在各个生物学层次理解人群易感性的差异。1999—2019年,全球在PTS环境暴露与健康效应领域论文发表数量逐年增加,学科总体处于一个稳定发展时期。发表的相关论文来自全球91个国家和地区,其中发文量排名前5位的国家依次为美国、中国、日本、加拿大和意大利,数量分别为2 707、1 743、479、443和398篇。总体上看,美国在该领域的研究数量居于领跑地位。中国在该领域的相关研究从1999年的2篇(占全球发文量的1%)增长到2019年的252篇(占全球发文量的29%),呈现指数型增长趋势。由此可见,西方发达经济体在环境与健康研究方面早已提前出发,其多学科协作已逐步建成良好的沟通交流机制。
2.2 国内现状与发展态势早在20世纪70年代,国内研究团队便已率先开展了PTS的相关研究和环境监测标准方法体系的建设,在环境分析方法与仪器设备研制、污染分布与演化趋势、污染物形态与环境化学行为及生态毒理效应等方面开展了系列基础性研究,为学科的建设与发展奠定了良好的基础,为我国PTS的环境管理及污染控制对策制定提供了科学依据。自2004年以来,由中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室发起并组织的系列国际会议“持久性有毒污染物国际研讨会”(International Symposium on Persistent Toxic Substances)已分别在中国、美国、日本、加拿大等国家与地区连续成功举办了16届,展现了良好的国际影响。
3 科学问题与挑战2007年发布的《国家环境与健康行动计划》明确规定,到2015年要完善环境与健康风险评估和风险预测预警工作,实现环境污染突发公共事件的多部门协同应急处置,基本实现社会各方面参与环境与健康工作的良好局面。此外,自2011年开始,由环境保护部(现“生态环境部”)会同国家卫生计生委(现“国家卫生健康委”)组织开展了“全国重点地区环境与健康专项调查”,涉及全国20多个省份,以了解我国重点地区的主要环境问题及对人群健康的影响,评估环境污染带来的健康风险,并提出环境与健康管理综合防治对策。尽管国家已投入大量资源开展环境污染与健康研究工作,但相较于发达国家,我国在此领域起步较晚,布局较少,研究还没有形成完整系统的格局,仍存在研究广度深度不够、科学问题碎片化等问题。特别是在生命科学与医学研究领域,虽然我国与发达国家的差距在逐渐缩小,但在人才队伍、创新能力、基础设施等方面仍有不小的差距,因此限制了我国PTS的环境健康研究。此外,特定的社会发展阶段、基础科研数据的缺失、不合理的学科布局等现实因素,都制约了环境污染与健康研究的发展及系统研究体系的建立。
环境健康研究的终极目标是探索环境因素如何影响人类健康,并通过改善生态环境保障公众安全。因此,针对我国当前面临的环境健康现实问题,亟待解决以下关键问题:
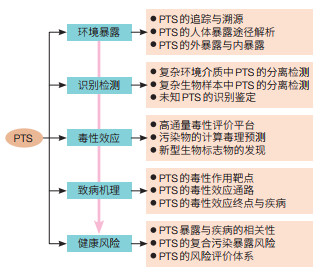
(1)改进、提高对具有健康危害PTS的识别能力与研究方法。研究并发展实际环境和生物样品中PTS的分离、鉴定与溯源技术,建立PTS的高通量毒性评价平台;发展PTS的计算毒理学方法,解析高风险PTS的毒性作用通路,发展新的生物标志物,以提高有毒污染物的识别能力(图 1)。
|
| 图 1 我国持久性有毒污染物(PTS)环境健康研究的主要科学问题与挑战 |
(2)明确PTS的外暴露与内暴露风险。在真实环境中,PTS呈现复合污染特征。一方面,已知PTS组分的毒性效应与疾病风险并不完全明确;另一方面,尚有许多未知的PTS组分,其毒理与健康效应无从知晓。因此,亟待基于生物毒性效应识别可能具有致病风险的关键组分,阐明从PTS暴露到机体损伤与健康危害的过程;依据流行病学统计数据,甄别损害人体健康的“责任”污染物,打造“环境分析—生物毒理—临床医学”多学科结合的研究体系(图 1)。
(3)揭示PTS的毒性效应与致病机理。在明确高风险PTS暴露导致主要健康问题的基础上,阐释污染物诱发疾病的机理,揭示污染物与生物分子的相互作用机制,构建污染物影响疾病发生、发展的评价体系(图 1),为防控高风险PTS提供理论依据。
4 政策建议作为生态环境科学的重点领域,环境污染与健康研究的学科发展与政策制定,关系到我国生态文明建设、社会可持续发展和人民群众身体健康,属于国家重大战略需求。
(1)尽快建立高风险PTS的监测体系与管理标准。 ①需要建立国家层面的PTS监测网络,全面掌握我国人群PTS的实际暴露水平与分布特征,客观评估PTS造成潜在健康问题与疾病的风险与危害;②需要区别管理不同健康风险的PTS,针对高健康风险PTS实施更严格和完善的管理标准,如质量标准与排放标准。
(2)加强PTS环境健康领域的交叉学科建设及人才梯队培养。通过设立重大专项,对前沿PTS环境健康问题进行科学探索,促进环境科学、公共卫生、临床医学等不同学科间的交叉融合,解决不同学科分兵作战的问题,加强科研团队建设与人才培养,打造PTS环境健康综合研究体系与平台。
(3)针对我国典型PTS污染区域的环境健康问题进行科研攻关。依托科研机构,围绕国内典型的PTS人群暴露地区或职业人群进行科技攻关,明确PTS人体暴露与重大疾病发生的关联性,确定潜在的致病因素,提高健康风险识别能力,以解决现实环境问题。
| [1] |
Wong M H, Armour M A, Naidu R, et al. Persistent toxic substances:Sources, fates and effects. Reviews on Environmental Health, 2012, 27(4): 207-213. |
| [2] |
江桂斌. 持久性有毒污染物的环境化学行为与毒理效应. 毒理学杂志, 2005, 19(3): 179-180. |
| [3] |
江桂斌, 史建波. 前言:环境化学与生态毒理学国家重点实验室专刊. 中国科学:化学, 2018, 48(10): 1149-1150. |
| [4] |
王亚韡, 蔡亚岐, 江桂斌. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展. 中国科学:化学, 2010, 40(2): 99-123. |
| [5] |
郑明辉, 谭丽, 高丽荣, 等. 履行《关于持久性有机污染物的斯德哥尔摩公约》成效评估监测进展. 中国环境监测, 2019, 35(1): 1-7. |
| [6] |
Vineis P, Fecht D. Environment, cancer and inequalities-The urgent need for prevention. European Journal of Cancer, 2018, 103: 317-326. DOI:10.1016/j.ejca.2018.04.018 |
| [7] |
Fernández M N F, Ching L A, Olry de L L A, et al. Relationship between exposure to mixtures of persistent, bioaccumulative, and toxic chemicals and cancer risk:A systematic review. Environmental Research, 2020, 188: 109787. DOI:10.1016/j.envres.2020.109787 |
| [8] |
Casals C C, Desvergne B. Endocrine disruptors:From endocrine to metabolic disruption. Annual Review of Physiology, 2011, 73(1): 135-162. DOI:10.1146/annurev-physiol-012110-142200 |
| [9] |
Zong G, Grandjean P, Wu H Y, et al. Circulating persistent organic pollutants and body fat distribution:Evidence from NHANES 1999-2004. Obesity, 2015, 23(9): 1903-1910. DOI:10.1002/oby.21161 |
| [10] |
Han X, Meng L L, Li Y M, et al. Associations between exposure to persistent organic pollutants and thyroid function in a case-control study of East China. Environmental Science & Technology, 2019, 53(16): 9866-9875. |
| [11] |
Vafeiadi M, Georgiou V, Chalkiadaki G, et al. Association of prenatal exposure to persistent organic pollutants with obesity and cardiometabolic traits in early childhood:The rhea mother-child cohort (Crete, Greece). Environmental Health Perspectives, 2015, 123(10): 1015-1021. DOI:10.1289/ehp.1409062 |
| [12] |
Wolf K, Bongaerts B W C, Schneider A, et al. Persistent organic pollutants and the incidence of type 2 diabetes in the CARLA and KORA cohort studies. Environment International, 2019, 129: 221-228. DOI:10.1016/j.envint.2019.05.030 |
| [13] |
Mustieles V, Fernández M F, Martin O P, et al. Human adipose tissue levels of persistent organic pollutants and metabolic syndrome components:Combining a cross-sectional with a 10-year longitudinal study using a multi-pollutant approach. Environment International, 2017, 104: 48-57. DOI:10.1016/j.envint.2017.04.002 |
| [14] |
Eskenazi B, Rauch S A, Tenerelli R, et al. In utero and childhood DDT, DDE, PBDE and PCBs exposure and sex hormones in adolescent boys:The CHAMACOS study. International Journal of Hygiene and Environmental Health, 2017, 220(2): 364-372. DOI:10.1016/j.ijheh.2016.11.001 |
| [15] |
Yin S S, Tang M L, Chen F F, et al. Environmental exposure to polycyclic aromatic hydrocarbons (PAHs):The correlation with and impact on reproductive hormones in umbilical cord serum. Environmental Pollution, 2017, 220: 1429-1437. DOI:10.1016/j.envpol.2016.10.090 |
| [16] |
Pan W Y, Ye X Q, Yin S S, et al. Selected persistent organic pollutants associated with the risk of primary ovarian insufficiency in women. Environment International, 2019, 129: 51-58. DOI:10.1016/j.envint.2019.05.023 |
| [17] |
Ye X Q, Pan W Y, Li C M, et al. Exposure to polycyclic aromatic hydrocarbons and risk for premature ovarian failure and reproductive hormones imbalance. Journal of Environmental Sciences, 2020, 91: 1-9. DOI:10.1016/j.jes.2019.12.015 |
| [18] |
Sweeney M F, Hasan N, Soto A M, et al. Environmental endocrine disruptors:Effects on the human male reproductive system. Reviews in Endocrine & Metabolic Disorders, 2015, 16(4): 341-357. |
| [19] |
Bell G A, Perkins N, Buck Louis G M, et al. Exposure to persistent organic pollutants and birth characteristics:The upstate KIDS study. Epidemiology, 2019, 30(2): S94-S100. |
| [20] |
Pessah I N, Lein P J, Seegal R F, et al. Neurotoxicity of polychlorinated biphenyls and related organohalogens. Acta Neuropathologica, 2019, 138(3): 363-387. DOI:10.1007/s00401-019-01978-1 |
| [21] |
Kim S, Eom S, Kim H J, et al. Association between maternal exposure to major phthalates, heavy metals, and persistent organic pollutants, and the neurodevelopmental performances of their children at 1 to 2 years of age-CHECK cohort study. The Science of the Total Environment, 2018, 624: 377-384. DOI:10.1016/j.scitotenv.2017.12.058 |
| [22] |
Brown A S, Cheslack-Postava K, Rantakokko P, et al. Association of maternal insecticide levels with autism in offspring from a national birth cohort. American Journal of Psychiatry, 2018, 175(11): 1094-1101. DOI:10.1176/appi.ajp.2018.17101129 |
| [23] |
Lenters V, Iszatt N, Forns J, et al. Early-life exposure to persistent organic pollutants (OCPs, PBDEs, PCBs, PFASs) and attention-deficit/hyperactivity disorder:A multipollutant analysis of a Norwegian birth cohort. Environment International, 2019, 125: 33-42. DOI:10.1016/j.envint.2019.01.020 |
| [24] |
Perkins J T, Petriello M C, Newsome B J, et al. Polychlorinated biphenyls and links to cardiovascular disease. Environmental Science and Pollution Research, 2016, 23(3): 2160-2172. DOI:10.1007/s11356-015-4479-6 |
| [25] |
Penell J, Lind L, Salihovic S, et al. Persistent organic pollutants are related to the change in circulating lipid levels during a 5 year follow-up. Environmental Research, 2014, 134: 190-197. DOI:10.1016/j.envres.2014.08.005 |
| [26] |
Singh K, Chan H M. Association of blood polychlorinated biphenyls and cholesterol levels among Canadian Inuit. Environmental Research, 2018, 160: 298-305. DOI:10.1016/j.envres.2017.10.010 |
| [27] |
Sergeev A V, Carpenter D O. Hospitalization rates for coronary heart disease in relation to residence near areas contaminated with persistent organic pollutants and other pollutants. Environmental Health Perspectives, 2005, 113(6): 756-761. DOI:10.1289/ehp.7595 |
| [28] |
Arrebola J P, Fernandez M F, Martin O P, et al. Historical exposure to persistent organic pollutants and risk of incident hypertension. Environmental Research, 2015, 138: 217-223. DOI:10.1016/j.envres.2015.02.018 |
| [29] |
Lim J E, Lee S, Lee S, et al. Serum persistent organic pollutants levels and stroke risk. Environmental Pollution, 2018, 233: 855-861. DOI:10.1016/j.envpol.2017.12.031 |
| [30] |
Lind P M, van Bavel B, Salihovic S, et al. Circulating levels of persistent organic pollutants (POPs) and carotid atherosclerosis in the elderly. Environmental Health Perspectives, 2012, 120(1): 38-43. DOI:10.1289/ehp.1103563 |