2. 中国科学院西北生态环境资源研究院 甘肃省极端环境微生物资源与工程重点实验室 兰州 730000;
3. 兰州交通大学 环境与市政工程学院 兰州 730070
2. Key Laboratory of Extreme Environmental Microbial Resources and Engineering of Gansu Province, Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730000, China;
3. School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China
冰冻圈(cryosphere)是地球表层连续分布且具一定厚度的负温圈层,其组成要素包括冰川(含冰盖)、积雪、冻土、河冰、湖冰、海冰、冰架、冰山,以及大气圈内的冻结状水体,是地球上独特而极端的生物生境。冰冻圈科学和生命科学技术的进步与融合,促进了冰冻圈微生物研究,拓展了生命科学研究与应用的领域,丰富了地球生态系统的多样性。冰冻圈微生物谱,特别是冰芯微生物谱保存着古气候的信息,是研究全球气候变化的重要生物学信息宝库。全球变暖的提速,冰冻圈微生物活动对冰冻圈的反馈及其在冰冻圈温室气体排放中的作用,是当今全球变化不可忽视的重大科学问题。
现今地球冰冻圈,特别是冰芯、冰下湖等生境,与生命起源早期的地球有些许的相似之处;冰冻圈微生物的生命过程及特征,可能为我们深入了解生命的起源和生命的低温适应极限,提供某些启示。冰冻圈被认为是地球上类似于火星、木卫二、木卫三、木卫四和木卫六等星球的环境,冰冻圈微生物的线索有望为地外生命的探索提供启示[1]。
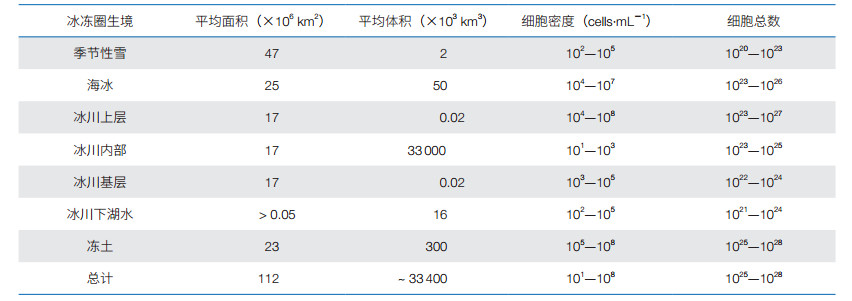
1 冰冻圈微生物的研究概况冰冻圈微生物的研究伴随着人类对极地、高山的探险和科学考察而开始,至今已开展了100多年的研究[2],经历了大致3个发展阶段:微生物形态学研究、微生物生理学研究和微生物组学研究。冰冻圈微生物研究范围涵盖了冰冻圈的主要要素——冻土、冰川、雪和海冰等;研究人员已经从冰冻圈各要素中发现并分离到多样性丰富的微生物类群,包括古菌、细菌和真菌等。最近一项权威的关于冰冻圈各生境中微生物细胞数量及总量的分析数据见表 1[3]。
1.1 冻土中的细菌和真菌冻土(permafrost)占地球陆地面积的25%,是地球冰冻圈中微生物重要的栖息场所,主要分布在南极、北极和高山等[4]。冻土微生物的研究很早就受到广泛重视,大量研究表明,冻土中生存着密度约为105—108 cells·g−1的多样性的微生物[4]。由于冻土的深度具有年代属性,可从中分离到不同年代的细菌,如:在西北利亚东北部约10万年冻土层中检测到1×107 cells·g−1活体微生物[5],在北极100万—300万年的冻土层检测到102—108 cells·g−1活的细菌[2]。
在冻土中,真菌主要以孢子形式存在,其数量远低于原核微生物细胞。其中,北极冻土可培养酵母数量为10 3—10 4 CFU·g−1,隶属于隐球酵母属(Cryptococcus)、红酵母属(Rhodotorula)、酵母属(Saccharomyces)和掷孢酵母属(Sporobolomyces);子囊菌门(Ascomycota)的地丝霉属(Geomyces)、枝孢霉属(Cladosporium)、青霉属(Penicillium)和曲霉属(Aspergillus)则是最常见的丝状真菌类群。相比之下,南极冻土中可培养酵母和丝状真菌数量往往很低,隐球酵母属和木克拉酵母属(Mrakia)为主要真菌类群[6]。在海冰中的真菌主要类群为硅藻,仅在北极地区就已鉴定了超过550种硅藻,包括446种壳缝羽纹硅藻(Pinnularia)和122种环纹硅藻(Centricdiatom) [4]。
1.2 雪冰中的细菌和真菌由于雪易取样,科研人员对其开展了较深入的微生物分析。对南极、北极和高山雪中微生物的分析表明,季节性雪中微生物细胞密度为102—105 cells · mL−1 [4],但其中微生物新种类较少。这主要是因为雪中微生物间接来源于土壤,大气输送决定了雪中微生物的来源与种类[7, 8]。
冰冻圈冰由冰川、极地冰架和海冰等组成。起初人们认为极地冰中没在微生物生存,但大量的分析表明各种类型的冰中都有微生物生长繁殖,其种类和细胞数量随冰的深度增加而减少。例如,表层冰中微生物细胞密度为104—108 cells · mL−1,冰川内部则下降到101—103 cells · mL−1 [4]。冰芯微生物主要来源于陆地尘土、洋面气溶胶和火山灰,其丰度与年降雪量相关,降雪越多的年份,冰芯中的微生物细胞数越多。从年代约200年的亚洲古里雅冰帽(Guliya Ice Cap)冰芯中检测到180 CFU · mL−1细菌细胞;年代约1800年的南极泰勒冰穹(Taylor Dome)冰芯中检测到0—10 CFU · mL−1细菌细胞[9]。格陵兰岛冰芯钻探项目(Greenland Ice Sheet Project,GISP2)钻取了深达3 042.80 m冰芯,检测到冰芯融水含有6.1×107— 9.1×107 cells · mL−1微生物细胞[8]。冰穴(cryoconite hole)是冰架和冰川上冰的局部消融而形成的微生境,其微生物群落具有独特性——其相对较高的丰度和活性,对冰川的消融和冰川上碳循环有重要影响[10]。海冰尽管具有较高的盐分,但也检测到微生物细胞密度为102—105 cells · mL−1 [4]。南极和北极冰下封存了数十万年的冰下湖是冰冻圈中更为独特的生境,其中也检测到密度为102—105 cells · mL−1微生物细胞[4]。近年来,从雪冰中分离到种类丰富的真菌[6];其中,从斯瓦尔巴特岛冰川冰芯中检测到3×103—1×104 CFU · mL−1酵母细胞[11],从阿尔卑斯山冰川冰中分离到许多喜冷和嗜冷的酵母菌[12]。
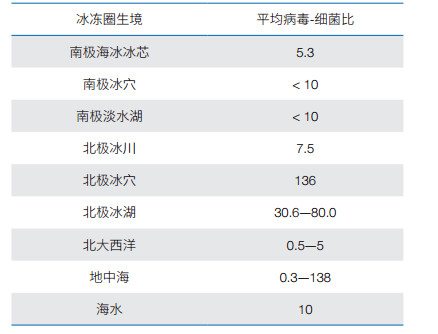
1.3 冰冻圈病毒冰冻圈生境营养水平低,生物链很短,因而,病毒对冰冻圈生态系统和物质循环具有重要影响。病毒通过裂解宿主细胞,控制细菌和真菌的多样性和丰富度,并可向环境中释放有机物质;通过基因水平转移,影响宿主细菌演化与进化[13]。近年来,随着病毒宏基因组技术的成熟,冰冻圈病毒的研究成为热点,特别是对南北两极冰川[14]、冰架、湖水[15]、土壤[16]和海冰[17]等,进行了较广泛和深入地研究。至今,在南极和北极的各种生境中检测到相对高丰度和多样性病毒,包括噬菌体、环状单链DNA病毒、双链DNA病毒、浸染藻类的phycoDNAviruses和噬病毒体(virophages)等DNA病毒,以及Picornavirales等RNA病毒[18]。在南极Taylor Valley冰穴鉴定到归属于Microviridae科DNA病毒[19]。计算机分析估计在南极冰层湖泊中存在大约10 000种病毒,远高于北美湖泊中的约800种病毒[20]。南极和北极海冰中类病毒粒子(virus-like particles)的密度达到105—108 mL−1 [17];在南极海冰冰芯中类病毒粒子平均丰度10.9×105 mL−1,平均病毒-细菌比(virus-to-bacteria ratio) 5.3 [21, 22]。平均病毒-细菌比是了解冰冻圈中病毒丰度及其与宿主关系的指标,尽管不同生境中这一数据变化较大,但是已经收集到的数据表明,南极和北极的冰及冰穴中具有很高的病毒-细菌比(表 2)。
近年来随着相关研究范围的扩大,对冰冻圈中病毒的相关认知不断加深。通过对青藏高原古里雅冰川距今520年和1.5万年的冰芯中相关病毒的基因组分析,发现了属于33种不同的病毒遗传信息,这些病毒可归类为4个已知属、28个未知属。基因预测分析结果显示,其中18个病毒种与冰芯中多种细菌数量密切相关,这表明病毒在冰芯中宿主多样化[23]。西伯利亚冻土中分离出的3万年前的巨病毒,仍具有感染目标宿主的活性[24]。阿拉斯加冻土中亦发现了大量的病毒,其主要分布于冻土的未冻结水中[25]。
2 冰冻圈中的微生物资源 2.1 冰冻圈中的新微生物冰冻圈中微生物的进化受其环境的独特性影响,其中适应性强的微生物物种和类群逐渐成为各个冰冻圈要素中的优势类群。经过数千乃至数百万年的进化与演化,形成了稳定的微生物群落和生态系统。近百年中,研究人员已经从冰冻圈中分离到大量的微生物新物种或类群,包括新的古菌、细菌和真菌。随着分子生物学技术的发展,冰冻圈微生物新种的分离和鉴定也在提速,越来越多的新种将被报道。今后,我们面临的任务,就是要赶在某一冰冻圈生境消失前,最大限度地将其中的新微生物分离并保存,为进一步研究和利用保存微生物资源。
冰冻圈的极端生存条件不仅塑造微生物的类群,也改变着微生物的代谢途径;在进化历程中,这种改变不断增加微生物的环境适应能力。微生物的新代谢产物为人类获得新的生物活性化合物提供了可能,如抗生素等。例如,近年来,笔者实验室从青藏高原冻土中分离了多株具有抗超级细菌——MRSA (methicillin-resistant Staphylococcus aureus)活性的链霉菌新种;对这些链霉菌次生代谢产物的分离分析表明,一些新的化合物具有作为抗生素的应用前景。目前,这项研究正在进行之中[26, 27]。
2.2 冰冻圈中的嗜冷微生物冰冻圈的低温环境选择了生存于其中的微生物的冷适应进化——已经分离并进行研究的嗜冷微生物和耐冷微生物都是从冰冻圈获得的。其中,研究较为深入的嗜冷菌包括分离自北冰洋沉积物的Colwellia psychrerythraea 34H、北极海冰的Psychromonas ingrahamii、北极湖冰的Methanococcoides burtonii DSM 6242、北极冻土的Planococcus halocryophilus、南极土壤的Arthrobacter sp. TAD20和Arthrobacter psychrolactophilus F2等[28]。从冰冻圈生境中也分离到了很多的耐冷霉菌和酵母菌。
嗜冷微生物的分离、培养、研究和利用为冰冻圈微生物资源开发提供了重要的菌株资源。嗜冷微生物的研究,使我们深入认识了微生物适应冷环境的各种机制;还为我们提供了多种低温菌、低温酶和低温蛋白,而这些菌株、酶和蛋白质已经应用到工业、农业、医疗和环境保护等各个领域,取得了巨大的经济与社会效益;一些冷适应微生物在生物能源方面也展示了良好的前景。例如,从南极冰上分离的Chlamydomonas sp. ICE-L在0℃和5℃条件下积累脂的量高于15℃条件下的量,在6℃条件下脂类积累量达到84 μL · L−1 [29]。南极耐冷酵母Mrakia blollopsis SK-4在10℃可高效转化木质纤维素为乙醇[30]。这些嗜冷微生物和冷适应相关基因与生物技术的结合,正在促生新的生物技术产业[31]。
2.3 冰冻圈中基因资源尽管冰冻圈可能蕴藏着大量的具有重要应用价值的微生物物种,但只有很小比例的微生物能够在实验室分离并培养,这极大地限制了冰冻圈微生物的研究与利用。宏基因组学技术为我们提供了一个全新的策略:通过全面测定环境中微生物的DNA序列信息,并组装环境样本中的基因组和基因,不仅可以揭示其中微生物的系统和代谢多样性及其环境适应性,还能够鉴定相关的功能基因,进而开展基因功能的深入分析和异源表达,获得相应的蛋白质。例如,宏基因组研究揭示了德国Schneeferner冰川冰中存在与冷适应相关的基因,包括冷保护剂(cryoprotectants)合成和多不饱和脂肪酸合成相关的基因[32]。
3 冰冻圈退化带来的微生物挑战 3.1 全球变暖正在改变冰冻圈生态系统当今,人类面临的最大挑战之一就是全球变暖。冰冻圈是地球上对全球变化最敏感的圈层;地球变暖正在导致冰冻圈的快速减少,包括冰川退缩和冻土消融[33]。然而,冰冻圈的退缩将对其中的微生物生物多样性,以及下游生态系统及其生物多样性产生何种影响,人们仍然一无所知。占地球陆地面积约1/4的冻土是地球重要的碳库。全球温升将加速冻存于冻土中的有机碳和营养物质微生物转化,导致温室气体CO2、CH4和N2O释放[34]。约占地球陆地面积10%的冰川退缩,将直接导致长时期储存于其中的无机物和有机物(包括污染物)释放。埋藏于冰中的各种营养物质释放,将影响下游水系和陆地生态系统及其生物多样性。
3.2 冰冻圈退化加速冰冻圈微生物生境的消失长期的低温选择了适冷性冰冻圈微生物,造就了冰冻圈微生物的独特性。多数的冰冻圈微生物种类只能生存于冰冻圈生境,而冰冻圈消融将对其中微生物产生灾难性影响,特有种类将从此消失。一项研究表明,在所有对冰川退缩发生响应的生物类群中,约6%—11%的物种成为响应的失败者,而19%—26%成为响应的胜利者。大部分的失败者是冰川生境的特有类群,其中一些类群只能生存在冰川生态系统。而响应的胜利者则是广布类群或入侵类群,通常能在冰川下游生境定居[33]。在冻土中,存在以休眠状态封存于其中数千年甚至数百万年的微生物,这其中有大量的种类为未知种类[35, 36]。冻土的消融将导致其生境的改变,使这些未知的微生物种类在被认知前就已消失。
3.3 冰冻圈消融释放未知的微生物如前文所述,冰冻圈中生存着许多未知的微生物类群,这些新的未知的微生物必然对下游生态系统乃至人类社会产生重大影响。长期封存于冰冻圈内的微生物中是否有新的致病微生物,包括动物、植物和人类的致病微生物;特别是冰冻圈病毒,其释放后将带来何种影响,是一个严峻的挑战。显然,对这一问题目前还缺乏研究。一项对冰冻圈病毒的研究表明,每年约有3.15×1021个细菌和古菌细胞从北极冰川冰中释放到下游环境中[37]。按照冰川中平均病毒-细菌比为30:1计算,那么每年将有1023个病毒从北极冰川释放到下游环境[38]。在这过程中,被困于冰冻圈中几万到数十万年的细菌和病毒会直接释放到环境中,这对人类生存产生潜在危害。2016年,西伯利亚爆发了炭疽热,2 000多头驯鹿因此死亡,并使得96人住院。相关研究表明,此次疫情是由于多年冻土的融化使得一具感染了炭疽芽孢的鹿尸解冻而引起的。此外,相关研究自西伯利亚冻土中复活了一种具有3万年历史的巨病毒,并发现这种病毒仍可感染它的靶标——单细胞变形虫[24]。随着全球变暖的加剧,冰冻圈释放未知的微生物进程将提速,将有更多的病毒随着极地和高山冰川融水而进入下游海洋和河流。如此巨量的病毒粒子将要在新的生态系统中传播和生存,并具备侵染完全不同宿主的可能性,这将对新的宿主生态系统产生重大影响。
4 展望冰冻圈微生物,特别是冰冻环境如冰川和冻土中的微生物,越来越受到关注。冰冻圈对地球气候变化的敏感性使我们认识到弄清楚冰冻圈微生物及其作用的迫切性。新技术的快速出现及其与传统技术的结合与互补,有力地促进了冰冻圈微生物研究的发展,特别是在微生物基因和潜在功能基因及其表达,以及微生物的原位代谢活性研究等方面,已经取得了重要进展。DNA测序成本的下降和比较基因组分析手段的提升,有助于更好地揭示冰冻圈微生物的冷适应特征与进化,查清微生物类群专一性的冷适应特征与机制,这些研究也将促进冷适应微生物及其细胞组分的生物技术应用[31]。全球变化节奏的加快,迫切要求我们加快对冰冻圈微生物及其响应全球变化的研究。为此,需要在以下4个方面深入开展工作。
(1)加强全球变化背景下冰冻圈微生物生态学研究。当前,我们对冰冻圈微生物研究还局限于以实验室研究为主,特别是在冰冻圈微生物生态学研究中,运用数学生态模型预测微生物群落的动态及其功能对全球变化的响应的研究还很少,因此加强多学科理论整合与实验研究的结合,是今后需要提升的方向;气候变化威胁冰冻圈微生物多样性,迫切需要了解冰冻圈生物多样性与气候和功能间的联系;与气候变暖(如冰川退缩和冻土消融)相关的冷适应微生物的功能与行为,将怎样响应气候变化;未来的研究需要多学科的综合视角,在时间与空间维度上,综合考察化学、物理、生物和环境的因素之间的相互作用与反馈。
(2)冰冻圈病毒的研究是另一个日益受到重视的领域。目前,有关冰冻圈病毒群落及其适应极端环境的科学研究资料还很有限。通过病毒宏基因组分析鉴定病毒基因编码的生物功能,了解其与病毒对极端环境适应性的关系,进而揭示病毒在冰冻圈中的作用。
(3)迫切需要加强对冰冻圈微生物的培养研究,为后续的研究与利用,获得和保存尽可能多的冰冻圈可培养微生物资源。深入了解各种冰冻圈生境中潜在的动、植物致病性微生物,特别是封存于其中的古老的、尚未发现的新致病性微生物,也是今后的重要任务。
(4)青藏高原是冰冻圈微生物研究值得重点关注的区域之一。我国境内分布有地球中纬度区面积最大、数量最多的冰川和冻土,而青藏高原是地球两极之外最大的冰冻圈生境。近年来,我国科学工作者在青藏高原上已经开展了大量的微生物研究,但这些研究主要集中在微生物生态学与微生物自然地理学等领域[39, 40]。加强全球变化背景下冰冻圈微生物与气候、环境间的相关性研究工作,是我国冰冻圈微生物研究者的使命。
| [1] |
Garcia-Lopez E, Cid C. Glaciers and ice sheets as analog environments of potentially habitable icy worlds. Frontier in Microbiology, 2017, 8: 1407. |
| [2] |
Gilichinsky D A, Wagener S. Microbial life in permafrost:A historical review. Permafrost and Periglacial Processes, 1995, 6: 243-250. |
| [3] |
Boetius A, Aneesio A M, Deming J W, et al. Microbial ecology of the cryosphere:Sea ice and glacial habitats. Nature Reviews Microbiology, 2015, 13: 677-690. |
| [4] |
Graham D E, Wallenstein M D, Vishnivetskaya T A, et al. Microbes in thawing permafrost:The unknown variable in the climate change equation. ISME Journal, 2012, 6: 709-712. |
| [5] |
Gilichinsky D A, Vorobyova E A, Erokhina L G, et al. Longterm preservation of microbial ecosystems in permafrost. Advances in Space Research, 1992, 12(4): 255-263. |
| [6] |
Hassan N, Rafiq M, Hayat M, et al. Psychrophilic and psychrotrophic fungi:A comprehensive review. Reviews in Environmental Science and Biotechnology, 2016, 15: 147-172. |
| [7] |
Cameron K, Hagedorn B, Dieser M, et al. Diversity and potential sources of microbiota associated with snow on western portions of the Greenland Ice Sheet. Environmental Microbiology, 2015, 17(3): 594-609. |
| [8] |
Miteva V I, Sheridan P P, Brenchley J E. Phylogenetic and physiological diversity of microorganisms isolated from a deep Greenland glacier ice core. Applied and Environmental Microbiology, 2004, 70: 202-213. |
| [9] |
Anesio A M, Laybourn-Parry J. Glaciers and ice sheets as a biome. Trends in Ecology and Evolution, 2012, 27(4): 219-225. |
| [10] |
Sanyal A, Antony R, Samui G, et al. Microbial communities and their potential for degradation of dissolved organic carbon in cryoconite hole environments of Himalaya and Antarctica. Microbiological Research, 2018, 208: 32-42. |
| [11] |
Singh P, Tsuji M, Singh S M, et al. Taxonomic characterization, adaptation strategies and biotechnological potential of cryophilic yeasts from ice cores of Midre Lovénbreen glacier, Svalbard, Arctic. Cryobiology, 2013, 66: 167-175. |
| [12] |
Turchetti B, Buzzini P, Goretti M, et al. Psychrophilic yeasts in glacial environments of Alpine glaciers. FEMS Microbiology Ecology, 2008, 63: 73-83. |
| [13] |
Bellas C M, Anesio A M. High diversity and potential origins of T4-type bacteriophages on the surface of Arctic glaciers. Extremophiles, 2013, 17: 861-870. |
| [14] |
Rassner S M E, Anesio A M, Girdwood S E, et al. Can the bacterial community of a high arctic glacier surface escape viral control?. Frontier in Microbiology, 2016, 7: 956. |
| [15] |
Adriaenssens E M, Kramer R, Van Goethem M W, et al. Environmental drivers of viral community composition in Antarctic soils identified by viromics. Microbiome, 2017, 5: 83. |
| [16] |
Zablocki O, van Zyl L, Adriaenssens E M, et al. High-level diversity of tailed phages, eukaryote-associated viruses, and virophage-like elements in the metaviromes of Antarctic soils. Applied and Environmental Microbiology, 2014, 80: 6888-6897. |
| [17] |
Paterson H, Laybourn-Parry J. Antarctic sea ice viral dynamics over an annual cycle. Polar Biology, 2012, 35: 491-497. |
| [18] |
Rastrojo A, Alcamí A. Viruses in polar lake and soil ecosystems. Advances in Virus Research, 2018, 101: 39-54. |
| [19] |
Sommers P, Fontenele R S, Kringen T, et al. Single-stranded DNA viruses in Antarctic cryoconite holes. Viruses, 2019, 11: 1022. |
| [20] |
Lopez-Bueno A, Tamames J, Velazquez D, et al. High diversity of the viral community from an Antarctic lake. Science, 2009, 326: 858-861. |
| [21] |
Luhtanen A M, Eronen-Rasimus E, Oksanen H M, et al. The first known virus isolates from Antarctic sea ice have complex infection patterns. FEMS Microbiology Ecology, 2018, 94(4). DOI:10.1093/femsec/fiy028 |
| [22] |
Madan N J, Marshall W A, Laybourn-Parry J. Virus and microbial loop dynamics over an annual cycle in three contrasting Antarctic lakes. Freshwater Biology, 2005, 50: 1291-1300. |
| [23] |
Zhong Z, Solonenko N E, Li Y, et al. Glacier ice archives fifteen-thousand-year-old viruses. bioRxiv, 2020. DOI:10.1101/2020.01.03.894675 |
| [24] |
Legendre M, Bartoli J, Shmakova L, et al. Thirty-thousandyear-old distant relative of giant icosahedral DNA viruses with a pandoravirus morphology. PNAS, 2014, 111(11): 4274-4279. |
| [25] |
Colangelo-Lillis J, Eicken H, Carpenter S D, et al. Evidence for marine origin and microbial-viral habitability of sub-zero hypersaline aqueous inclusions within permafrost near Barrow, Alaska. FEMS Microbiology Ecology, 2016, 92: 1-15. |
| [26] |
Zhang B, Tang S, Chen X, et al. Streptomyces lacrimifluminis sp. nov., a novel actinobacterium that produces antibacterial compounds, isolated from soil. International Journal of Systematic and Evolutionary Microbiology, 2016, 66: 4981-4986. |
| [27] |
Zhang B, Tang S, Chen X, et al. Streptomyces qaidamensis sp. nov., isolated from sand in the Qaidam Basin, China. The Journal of Antibiotics, 2018, 71: 880-886. |
| [28] |
Bowman J P. Genomics of psychrophilic bacteria and archaea//Margesin R, ed. Psychrophiles: From Biodiversity to Biotechnology. Switzerland: Springer, 2017: 345-387.
|
| [29] |
An M, Mou S, Zhang X, et al. Temperature regulates fatty acid desaturases at a transcriptional level and modulates the fatty acid profile in the Antarctic microalga Chlamydomonas sp. ICE-L. Bioresource Technology, 2013, 134: 151-157. |
| [30] |
Tsuji M, Yokota Y, Kudoh S, et al. Improvement of direct ethanol fermentation from woody biomasses by the Antarctic basidiomycetous yeast, Mrakia blollopis, under a low temperature condition. Cryobiology, 2014, 68(2): 303-305. |
| [31] |
Collins T, Margesin R. Psychrophilic life styles:Mechanisms of adaptation and biotechnological tools. Applied Microbiology and Biotechnology, 2019, 103(7): 2857-2871. |
| [32] |
Simon C, Wiezer A, Strittmatter A W, et al. Phylogenetic Diversity and metabolic potential revealed in a glacier ice metagenome. Applied and Environmental Microbiology, 2009, 75: 7519-7526. |
| [33] |
Cauvy-Fraunié S, Dangles O. A global synthesis of biodiversity responses to glacier retreat. Nature Ecology and Evolution, 2019, 3: 1675-1685. |
| [34] |
Nikrad M P, Kerkhof L J, Häggblom M M. The subzero microbiome:Microbial activity in frozen and thawing soils. FEMS Microbiology Ecology, 2016, 92(6): 1-16. |
| [35] |
Gilichinsky D A, Wilson G S, Friedmann E I, et al. Microbial populations in Antarctic permafrost:Biodiversity, state, age, and implication for astrobiology. Astrobiology, 2007, 7: 275-311. |
| [36] |
Frey B, Rime T, Phillips M, et al. Microbial diversity in European alpine permafrost and active layers. FEMS Microbiology Ecology, 2016, 92(3): 1-17. |
| [37] |
Irvine-Fynn T D, Edwards A. A frozen asset:The potential of flow cytometry in constraining the glacial biome. Cytometry Part A, 2014, 85: 3-7. |
| [38] |
Anesio A M, Mindl B, Laybourn-Parry J, et al. Viral dynamics in cryoconite holes on a high Arctic glacier (Svalbard). Journal of Geophysical Research:Biogeosciences, 2007, 112: G04S31. |
| [39] |
Donhauser J, Frey B. Alpine soil microbial ecology in a changing world. FEMS Microbiology Ecology, 2018, 94: fiy099. |
| [40] |
Hu W G, Zhang Q, Tian T, et al. The microbial diversity, distribution, and ecology of permafrost in China:A review. Extremophiles, 2015, 19(4): 693-705. |