编者按 党的十九届四中全会提出,“健全科技伦理治理体制”。科技伦理治理体制作为国家治理体系的重要组成部分,对于克服科技领域存在的伦理问题、促进我国科技事业健康发展,具有重要意义。科技伦理作为科技活动必须遵守的价值准则,已成为国际社会高度重视的共同议题。深入探索我国科技伦理治理的着力点,推进国家科技治理体系和治理能力现代化,是“十四五”时期我国科技工作的重要内容。为引导科学共同体及全社会进一步深入讨论科技伦理治理在推进我国科技事业健康、有序发展中的关键性作用,强化其对科技活动的正确价值引导,在中国科学院学部工作局指导推进下,《中国科学院院刊》特组织策划“科技伦理治理的战略研究”专题,围绕中国科学院学部相关咨询项目内容,邀请领域专家学者进行深刻思考和系统阐述,以期对国家宏观决策提供科学支撑。
2. 中国科学院 学部工作局 北京 100190;
3. 中国科学院大学 北京 100049;
4. 北京大学 生命科学学院 北京 100871
2. Academic Divisions, Chinese Academy of Sciences, Beijing 100190, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. School of Life Sciences, Peking University, Beijing 100871, China
以CRISPR为代表的基因编辑技术已经成为生命科学领域重要的颠覆性技术之一。随着研究和应用不断深入,尤其是该技术用于人类基因的编辑之后,相关伦理问题探讨甚嚣尘上。2013年初,有研究表明基因编辑技术可用于编辑人类干细胞基因[1, 2]和改造整个生物体(斑马鱼)[3],就有学者开始关注到相关伦理问题①[4]。2015年,CRISPR/Cas9技术首次应用于人类胚胎编辑,引发基因编辑技术伦理和监管问题的热烈讨论。2018年11月,“基因编辑婴儿”诞生,再次将基因编辑的伦理问题及治理体系建设相关探讨推向高潮。本文简要概述近年来涉及伦理问题的基因编辑技术研究和应用进展,总结全球有关伦理治理的讨论和探索,并为我国基因编辑技术伦理治理体系建设提供一些思路和建议。
① Savulescu J. As a species, we have a moral obligation to enhance ourselves. (2014-02-19)[2021-10-29]. https://ideas.ted.com/theethicsof-genetically-enhanced-monkey-slaves/.
1 基因编辑技术研究和应用引发的伦理问题探讨基因编辑技术在人类健康、农业和食品等领域的研究和应用如火如荼,不断深入。一些涉及人体的研究和应用引起了多方面的伦理问题探讨。
1.1 基因编辑技术研究和应用进展迅速自2013年CRISPR技术诞生以来,基因编辑技术飞速发展,相关研究论文数量呈现指数增长趋势。据Web of Science核心合集数据库,到2020年,基因编辑技术相关论文数量达到近3万篇,年均增长率超过20%。
对于人类发育遗传机制的研究,模式动物有一定的局限性[5],而在人类胚胎上使用基因编辑技术则有显著的优势。人类胚胎基因编辑研究一方面是通过基因编辑敲除相关重要基因来研究人类早期胚胎发育机制,另一方面是探索修复潜在遗传疾病相关基因位点的可能。在遗传疾病基因修复方面,目前已在小鼠模型中成功实现了白内障[6]、酪氨酸血症[7]、肌营养不良[8]等疾病的治疗性胚胎基因编辑。但少量利用人胚胎基因编辑的研究,如范勇团队编辑受精卵CCR5基因探索艾滋病治疗[9],Ma等[10]编辑MYBPC3基因治疗肥厚型心肌病,Fogarty等[5]敲除了受精卵中的Oct4(POU5F1)基因研究胚胎的发育异常等,尽管符合相关的伦理规范,却都引起学界对其研究必要性及风险- 收益比合理性的质疑。
人类成体细胞基因编辑的临床应用,为一些没有其他有效治疗手段的疾病提供了治疗可能。四川大学华西医院卢铀等[11]开展的CRISPR基因编辑T细胞治疗癌症的Ⅰ期临床试验证明了该技术临床应用的可行性;Editas Medicine及Allergan公司的CRISPR/Cas9基因疗法AGN-151587(EDIT-101)用于遗传性眼病“莱伯氏先天性黑蒙症”(LCA10)的Ⅰ/Ⅱ期临床实验,已完成首例患者给药②;Intellia Therapeutics及再生元公司在研基因编辑疗法NTLA-2001已完成全球性Ⅰ期临床试验的首例转甲状腺素蛋白淀粉样变性(ATTR)患者给药,中期结果显示良好[12],并于2021年10月获得美国食品药品监督管理局(FDA)孤儿药认定③;CRISPR Therapeutics和Vertex Pharmaceuticals公司联合开发的基因编辑疗法已成功治愈了β-地中海贫血症和镰刀状细胞贫血症[13]。可以看到,基因编辑技术在疾病治疗中显示出巨大潜力。同时,也有学者指出,在人体内直接使用CRISPR/Cas9技术仍具有较大的技术挑战和安全隐患,因而使用时仍需谨慎。
② Editas Medicine. Allergan and Editas Medicine Announce Dosing of First Patient in Landmark Phase 1/2 Clinical Trial of CRISPR Medicine AGN-151587 (EDIT-101) for the Treatment of LCA10. (2020-03-04)[2021-10-29]. https://ir.editasmedicine.com/newsreleases/news-release-details/allergan-and-editas-medicine-announce-dosing-first-patient.
③ Intellia Therapeutics. Intellia Therapeutics Receives U.S. FDA Orphan Drug Designation for NTLA-2001, an Investigational CRISPR Therapy for the Treatment of Transthyretin (ATTR) Amyloidosis. (2021-10-21)[2021-10-29]. https://ir.intelliatx.com/news-releases/news-release-details/intellia-therapeutics-receives-us-fda-orphan-drug-designation.
此外,与人体应用相比,基因编辑技术在农作物育种、食品改良等领域的应用发展更加快速。美国农业部对基因编辑作物不再实施额外的监管,到2020年底,已批准70多种基因编辑作物。2020年12月,日本厚生劳动省通过了含有更多γ- 氨基丁酸的基因编辑西红柿的销售申请,预计最早将于2022年上市销售④。
④ 新华社. 日本批准销售基因编辑西红柿最早2022上市. (2020-12-12)[2021-03-03]. http://news.sciencenet.cn/htmlnews/2020/12/450087.shtm.
1.2 基因编辑技术涉及的伦理问题基因编辑技术快速发展的同时,相关伦理问题的研究也在同步展开。基因编辑技术涉及的伦理问题,可以从技术、社会和生态3个层面来探讨。
(1)在技术层面,基因编辑技术的伦理问题在于技术上尚不完善,可能导致应用过程中的诸多不确定性。基因编辑技术本身存在的风险包括:准确率不足导致的非预期编辑(即“脱靶效应”)[14],胚胎基因编辑效率低下产生未完全编辑细胞的“嵌合效应” [15],CRISPR/Cas9系统进入人体内导致的“免疫效应” [16],以及编辑特定功能性基因导致的不可预知的“副作用”等风险[17, 18]。例如,Alanis-Lobato等[19]的研究中,22% 的细胞中被检出在POU5F1周围发生大量突变,包括DNA重排和数千个碱基的缺失;Zuccaro等[20]使用CRISPR/Cas9纠正EYS2基因的突变后,约一半的胚胎丢失了大量的染色体片段,甚至是整个染色体;Liang等[21]发现,尽管基因转换可用于基因校正,但编辑范围会超出目标区域,导致广泛的杂合性损失(LOH),因此存在严重的安全隐患。这些风险及其可能导致的后果尚不能确定,难以较为清晰地分析其应用的“风险-收益”。
(2)在社会层面,基因编辑技术可能会对社会公平与正义产生冲击,使得人类本性尊严出现异化,导致社会发展伦理问题的出现。社会学家和伦理学家对于基因编辑技术伦理问题的探讨主要涉及3个方面:①基因选择可能带来的消极影响。在基因编辑技术临床应用边界模糊不清的情况下,父母可能通过产前检测及基因编辑手段进行人体的特质选择,从而加剧社会中存在的偏见和狭隘。②对家庭观念及共同利益的冲击。子女在有自主权和决策能力之前,父母是最合适的代理医疗决策者。但在漫长的时间尺度上,父母和子女在观念和共同利益一致性方面存在太多不确定性,可能涉及家庭关系、子女自主性等其他多种社会问题。③技术的平等获取和社会正义。基因编辑技术的临床应用,受到地域、种族人群、公共卫生覆盖范围、科技发展程度、社会经济地位等多方面的影响,很难成为大众普遍能够获取的技术。
(3)在生态层面,基因编辑技术对自然进化提出了挑战,破坏人类基因的完整性和进化性,进而改变整个人类基因库,带来不可控的风险后果。一方面,编辑后的基因遗传所带来的“多代效应”后果难以评估,种系基因编辑不仅会对个体本身产生意想不到的影响,对个体后代的影响也不可预估,可能会人为增加人类出现遗传问题的风险。另一方面,可能会损害整体的自然生态,包括人为进行定向基因选择是否会导致人类基因的多样性消失等。此外,广义上来讲,通过基因编辑技术导入外源基因的植物可能带来的生态环境问题、基因编辑食品所涉及的食品安全和监管,以及间接引发的法律规制等问题也可划入基因编辑伦理问题探讨的范畴。
2 国际基因编辑技术伦理问题研究和治理探索CRISPR技术首次用于人类胚胎基因编辑后,各国科学家在人类基因编辑峰会上达成共识:允许开展人类胚胎基因编辑的基础研究,但强调现阶段就把该技术投入临床使用的做法是“不负责任”的。这是国际上首次为基因编辑研究划定“红线”。此后,相关伦理问题的研究和讨论持续不断,尤其是“基因编辑婴儿”事件发生之后,各国进一步明确边界和监管措施,呼吁形成国际共识,建立健全治理制度。
2.1 世界各国积极完善基因编辑技术相关法律法规目前,全球约有30个国家制定了直接或间接禁止所有临床使用基因编辑技术的立法[22]。例如,澳大利亚、加拿大等国立法禁止人类胚胎/生殖细胞基因编辑、体细胞核移植技术,并通常伴随着巨额罚款或者刑事制裁;英国规定由相关的专业机构测评风险,允许通过授权许可的方式进行人类基因编辑。
此外,在基因编辑技术用于农业生产方面,各国也出台了更加明晰的措施。例如:美国通过对现有转基因技术相关法律法规进行修订和解释,使基因编辑作物免于严格的转基因监管;日本、芬兰、瑞典、俄罗斯、巴西、阿根廷等国家,也将基因编辑植物产品列为非转基因产品管理;与之相反,欧洲许多国家则将基因编辑作物视同于转基因作物进行监管。
2.2 国际组织发布共识报告,现阶段禁止种系基因编辑针对人类生殖系基因编辑技术的研究和应用,国际组织、各国政府、研究机构、学术团体等纷纷发表研究报告。大多数观点都认为可以进行人类生殖系基因编辑相关的基础研究,但在短期内应避免临床应用。在临床上使用人类生殖系基因改造之前必须满足一定的标准,包括克服安全和技术障碍,就应用边界达成社会共识,建立适当和透明的监管机制等(表 1)。
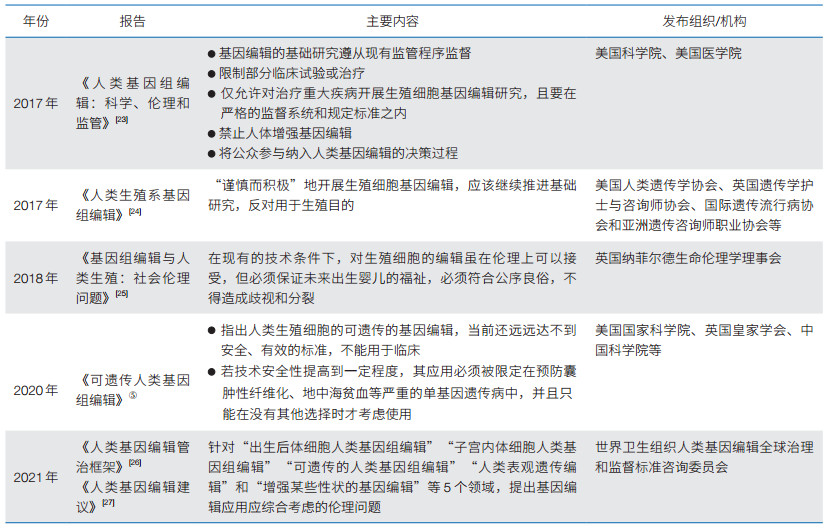
|
⑤ 新华网. 新闻分析:一条极窄路——从最新报告看可遗传人类基因组编辑技术应用前景. (2020-09-07)[2021-03-03]. http://www.xinhuanet.com/2020-09/07/c_1126463409.htm.
“基因编辑婴儿”事件发生之后,各国进一步发表声明,反对将基因编辑技术用于生殖目的。第二届人类基因组国际峰会组委会认为,任何人类生殖系基因编辑的临床使用都是极其不负责任的——其临床实践的结果过于不确定,风险太大[28]。2019年,世界卫生组织(WHO)成立人类基因编辑问题治理和监督的专家咨询委员会。该委员会负责审查与人类体细胞和生殖系细胞(包括早期胚胎)基因编辑相关的科学、伦理、社会和法律挑战,提出建立登记系统,为收集、管理种系和体细胞基因编辑研究(包括临床试验)的计划和正在进行的研究细节提供透明和结构化的机制等⑥。2021年7月,该委员会发布《人类基因编辑管治框架》与《人类基因编辑建议》,旨在帮助世界各国确保安全、有效、符合伦理要求地使用人类基因编辑技术[26, 27]。
⑥ 新华网. 世卫将世卫将制定人类基因编辑国际治理框架. (2019-03-20)[2021-03-03]. http://www.xinhuanet.com/world/2019-03/20/c_1124258632.htm.
2.3 学界呼吁加强基因编辑技术临床应用的监管除了相关智库和组织机构,越来越多的科学家发声,呼吁就基因编辑技术的临床应用形成共识,制定相关法律法规,保障技术健康有序、合理合规的发展(表 2)。

|
基因编辑技术的迅猛发展引起了全球生物医学研究领域的重大变革,基因编辑伦理的研究伴随着技术的发展得到了极大的重视。利用Web of Science核心合集数据库对全球基因编辑伦理研究的文献进行检索,检索时间为2021年10月26日,共得到587篇文献记录,仅占基因编辑论文总量的不到2%;其中,超过60% 的文献(共365篇文献)发表于2019年之后,也就是“基因编辑婴儿”事件发生之后。然而,2013年基因编辑技术就开始了大规模应用,2016年四川大学华西医院就开展了全球首个基因编辑的临床试验。由此可见,与技术相比,基因编辑伦理问题研究的“速度”及对技术发展影响的“程度”还远远不足。
从基因编辑伦理领域发文国家的分布来看,排在前5位的国家分别为美国(218篇)、英国(77篇)、德国(55篇)、中国(47篇)和澳大利亚(36篇)。美国作为基因编辑技术的来源国,也是全球基因编辑伦理领域发文最多的国家。中国在基因编辑技术领域的发文量位于全球第2位,在伦理领域也开展了相关的研究,位于全球第4位。
从内容来看,全球基因编辑伦理研究的重点主要包括4个领域:①人类生殖系细胞基因编辑的伦理问题。人类生殖细胞基因编辑是最受争议的伦理研究领域,研究普遍基于该领域的技术风险、道德争议、社会问题、各国法律法规及现有的国际监管共识展开;不少研究认为,与其完全暂停与禁止,不如建立一个能够平衡风险与收益,同时开放、合作和规范的全球研究框架[33]。②人类非生殖系细胞基因编辑的伦理问题。体细胞基因编辑的医疗价值受到广泛的重视,而“脱靶”等技术“短板”引发的安全风险是最受关注的领域。该技术的创始人之一Doudna[34]也发文称基因编辑技术亟待进一步完善,以确保这项突破性技术被负责任地用于治疗和预防遗传疾病。③农业领域动物与植物基因编辑的伦理问题。非人类细胞基因编辑的伦理问题主要集中于对生物安全问题的探讨,几乎所有文献均认可基因编辑在农业领域的巨大价值,但该领域仍需面对社会接受度与反转基因人群的挑战[35]。④生态领域动物与植物基因编辑的伦理问题。在生态环境领域的伦理研究对基因编辑作为潜在生物控制工具(如灭蚊[36]),以及恢复生态系统和生物多样性方面的潜力开展了讨论;但同时也提出该工具对于生态链影响的担忧,呼吁建立相关的监管框架[37]。
3 中国基因编辑技术伦理问题研究和治理体系建设近年来,中国在基因编辑技术的伦理监管和治理方面已有诸多重大进展。
3.1 基因编辑技术监管相关法律效力位阶提升中国对基因编辑技术的人体应用有严格的法律规范。科学技术部和卫生部(现“国家卫生健康委员会”)于2003年联合发布《人胚干细胞研究伦理指导原则》,禁止进行生殖性克隆人的任何研究,明确规定不得将获得的已用于研究的人囊胚植入人或其他动物的生殖系统;同年,卫生部颁布《人类辅助生殖技术和人类精子库伦理原则》,明确规定患者的配子和胚胎在未征得其知情同意情况下,不得进行任何处理,更不得进行买卖。2020年科学技术部发布的《生物技术研究开发安全管理办法》明确将“涉及存在重大风险的人类基因编辑等基因工程的研究开发活动”列为高风险等级,要求各级科研机构进行严格管理。
近年来,中国对于基因编辑技术等新兴生物技术的伦理监管与治理体系建设日益重视。中央全面深化改革委员会第九次会议上审议通过了《国家科技伦理委员会组建方案》。会议指出,科技伦理是科技活动必须遵守的价值准则。组建国家科技伦理委员会的目的就是加强统筹规范和指导协调,推动构建覆盖全面、导向明确、规范有序、协调一致的科技伦理治理体系。《民法典》也明确规定,从事与人体基因、人体胚胎等有关的医学和科研活动,应当遵守法律、行政法规和国家有关规定,不得危害人体健康,不得违背伦理道德,不得损害公共利益。这是中国首次在较高效力位阶的法律层面对人体基因、人体胚胎有关的医学和科研活动作出明确规定。
3.2 各大会议呼吁加强基因编辑技术的伦理监管随着基因编辑技术的快速发展,相关伦理问题的会议研究和讨论一直持续不断。 2016年6月,以“基因编辑技术的研究与应用”为主题的香山科学会议,就建议尽快部署基因编辑技术的监管和伦理学研究,对可能带来巨大伦理和社会问题的基因编辑工作应设定严格的边界,禁止临床试验和应用。“科学的责任与负责任的科学”第一届论坛暨“基因编辑技术中的伦理与责任”研讨会就基因编辑技术中的伦理与责任问题展开热烈讨论,对基因编辑技术如何进行立法提出建议,并建议提升有关基因编辑研究人员的职业素养。
基因编辑技术在全国两会上也引发热烈关注,基因编辑技术相关立法的呼声日益高涨。在2019年全国两会上有代表提出要明确基因编辑技术的应用边界,立法规范什么能做、什么不能做;呼吁对如人体试验招募、基因编辑胚胎受孕等研究,予以禁止性、限制性规定,同时提高违反规定的处罚力度,确保严格管理。时任中国科学院院长、党组书记白春礼在接受《科技日报》记者采访时说,在技术不成熟、相应的社会伦理问题未得到充分讨论解决之前,应当禁止对于人生殖系基因编辑的临床试验和应用;而对于基础性研究则可以允许科学家尝试探索。在2021年全国两会上,有代表建议出台相关研究的“伦理考量指导规范”,从原始来源、生产工艺、适应证等方面给出判断依据,综合考量伦理风险,指导临床试验/研究;对于涉及基因编辑等先进生物技术的研究,要加强生物伦理规范。
3.3 学界不断重视基因编辑伦理问题研究与探讨近年来,中国学界愈加重视基因编辑伦理问题研究,相关研究论文日益增长。据中国知网(CNKI)数据库,截至2021年10月,中国学者参与发表的基因编辑伦理相关中文文献超过500篇;主要研究机构有华中科技大学人文学院、复旦大学哲学学院、中国医学科学院/北京协和医学院人文学院、中国人民大学法学院、北京大学医学院、武汉理工大学等;这些文献围绕人类胚胎、生殖细胞等基因编辑技术相关的伦理争议、伦理反思、伦理道德、伦理审查、法律规制等进行研究和讨论。
尤其是“基因编辑婴儿”事件发生之后,中国科学家、伦理学家纷纷在国际期刊上发文表明态度。许多科学家呼吁国家在农业领域对基因编辑技术持积极开放态度,在健康领域及时出台相关政策、法规和条例来规范和引导,以推动基因编辑在中国的可持续健康发展。2018年科学家团队在Lancet发文,分别从科学伦理、科学政策,以及医学、科学与技术背景上,对基因编辑技术现状、人类胚胎研究伦理、CCR5基因与HIV预防的科学背景进行阐释分析,表达科学共同体的态度。雷瑞鹏、翟晓梅、邱仁宗等伦理学家在Nature上呼吁,以“基因编辑婴儿”事件为契机加强对医学研究的伦理监管[38];建议就人类基因编辑的是与非展开深入讨论,坚决反对有悖基本伦理的做法;督促科研人员在人类基因组编辑领域有所作为、有所不为[39]。
4 对于基因编辑技术伦理治理体系建设的建议基因编辑技术在带给人类进步的同时,也可能会因误用、滥用、谬用而带来潜在的安全风险及伦理问题。因此,需要政府、机构、科学共同体、行业协会、公众等各个层面的共同努力,全面系统地加强规范治理,才能保障技术在符合人类整体利益的轨道上,合理、有序、健康地发展。
4.1 政府层面应制定科学合理的治理制度(1)建立协调对话机制。相关立法部门组织跨学科跨部门协作,开展基因编辑技术等新兴技术治理制度研究,全面评估当前的治理体系,包括法制体系、监管体系、创新体系、审查体系等;通过分析技术特点,构想技术应用场景,研判技术发展趋势,针对不同对象(人、动物、植物、微生物),区别对待,完善技术治理体系,以满足技术迅速发展的需要。
(2)建立风险-收益评估体系。对于技术的战略性布局,在对相关研究项目进行资助之前,除了评估其科学意义,还要综合评估所带来的经济和社会意义,尤其是对生命伦理、生物安全和生物安保等潜在风险的预判和评估。
(3)建议制定《基因编辑技术医学研究指导原则》。对于基因编辑技术的医学应用研究,如相关疗法或药物研发,建议制定基因编辑技术临床前研究的技术路线,确定用于基因编辑技术临床应用的安全性评价的方法、标准、技术和工具等,并以此为基础进一步制定相关管理规范。
4.2 研究机构应承担管理监督的主体责任研究机构是基因编辑技术等新兴技术治理的第一责任主体[40]。2018年12月,教育部印发《关于高等学校开展基因编辑相关研究项目自查工作通知》,要求高校组织开展基因编辑相关研究项目的自查工作。在自查的同时也要对各高校伦理委员会章程、工作制度、工作程序进行梳理上报。
(1)相关研究机构完善管理和监督制度。在国家法律规范的框架下,制定研究机构规范开展科学研究的指南和制度;建立伦理审查委员会,采取有效措施保障伦理审查工作独立开展。
(2)对科研人员及相关管理人员开展教育培训。督促伦理审查人员始终保持公正、客观的态度和专业的伦理素养,营造规范的科研环境和治理氛围。
4.3 伦理监管应因地制宜,确保精准落实科学研究与伦理监管始终是在相互作用的过程中协同发展的。应用基因编辑技术开展的研究应当在现有的伦理监管框架下进行,而技术的进步又会带来新的伦理问题;这些问题为伦理监管带来新的挑战的同时,也在对话和讨论过程中促进伦理监管更加精确和完善。
(1)补充更有针对性的伦理监管路径。世界各国在基因编辑技术人类胚胎应用的边界问题上存在争辩:有人认为应该全面禁止人类胚胎应用,也有人认为应该是有条件暂停而不是绝对禁止。对于基因编辑技术所带来的新的伦理挑战,应该研究技术本身的发展规律和伦理问题特征,并在现有监管框架下补充更有针对性的伦理监管路径。
(2)从国家层面上建立起长效的新技术伦理监管研究和保障机制。在国家相关法律法规体系下,由伦理学家、科学家、社会学家及法学家共同参与伦理治理;在新兴技术出现时,及时启动相关伦理研究专项;基于新技术的特点、特定发展规律、应用领域和场景等,开展伦理问题研究、制定专项伦理准则,并切实保证监管精准到位。
4.4 科研共同体应牢记使命,加强自我约束科研人员作为基因编辑技术等新技术创新的“发源地”,具有避免或减少研究成果风险和伤害的责任。
(1)牢记“推动人类进步的崇高使命”。应站在全人类的利益高度开展科学研究,明确科学家要将真理“授之于众”、始终保护公众权益的责任所在,有所作为、有所不为。
(2)加强自我约束,积极参与相关伦理教育培训。科研人员应在研究行为符合人类整体利益需求的大前提下,自觉了解并遵守相关规章制度、指导方针和安全措施;充分了解所从事研究滥用、误用的可能性,识别伦理问题,掌握伦理分析决策方法,定期评估研究项目的生物安全风险,并及时调整和降低风险;在此基础上,承担起教育和培训他人的责任,在力所能及范围内,控制安全风险,这是科学家的社会责任所在。
4.5 其他参与者应共同促进治理生态的建设除了政府、监管机构、研究机构及科学家共同体以外,基因编辑技术这类新兴技术发展所涉及的其他参与者也会对技术的规范治理具有促进作用。
(1)在多环节、多层面开展全面广泛的伦理讨论。在资金资助、知识产权管理、试验材料管理、论文发表、同行评议、成果转化甚至医疗服务等多个环节,涉及基因编辑技术应用时的监督、管理和规范,也是整个治理生态的建设的重要组成部分。
(2)注重搭建公众对话平台。在公众科普方面,提升科研机构科普能力,并发挥媒体对公众基因编辑伦理的指引作用。通过多种媒体途径加强科学普及,同时注意对媒体的传播用语加以规范,让公众对基因编辑技术的优势与可能的风险有全面客观的认识。
| [1] |
Ding Q R, Regan S N, Xia Y L, et al. Enhanced efficiency of human pluripotent stem cell genome editing through replacing TALENs with CRISPRs. Cell Stem Cell, 2013, 12(4): 393-394. DOI:10.1016/j.stem.2013.03.006 |
| [2] |
Musunuru K. Genome editing of human pluripotent stem cells to generate human cellular disease models. Disease Models & Mechanisms, 2013, 6(4): 896-904. |
| [3] |
Chang N N, Sun C H, Gao L, et al. Genome editing with RNAguided Cas9 nucleasein Zebrafish embryos. Cell Research, 2013, 23(4): 465-472. DOI:10.1038/cr.2013.45 |
| [4] |
Araki M, Ishii T. International regulatory landscape and integration of corrective genome editing into in vitro fertilization. Reproductive Biology and Endocrinology, 2014, 12: 108. DOI:10.1186/1477-7827-12-108 |
| [5] |
Fogarty N M E, McCarthy A, Snijders K E, et al. Genome editing reveals a role for OCT4 in human embryogenesis. Nature, 2017, 550: 67-73. DOI:10.1038/nature24033 |
| [6] |
Wu Y X, Liang D, Wang Y H, et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell, 2013, 13(6): 659-662. DOI:10.1016/j.stem.2013.10.016 |
| [7] |
Yin H, Xue W, Chen S D, et al. Genome editing with Cas9 in adult micecorrects a disease mutation and phenotype. Nature Biotechnology, 2014, 32(6): 551-553. DOI:10.1038/nbt.2884 |
| [8] |
Xu L, Park K H, Zhao L X, et al. CRISPR-mediated genome editing restores dystrophin expression and function in mdx mice. Molecular Therapy, 2016, 24(3): 564-569. DOI:10.1038/mt.2015.192 |
| [9] |
Kang X J, He W Y, Huang Y L, et al. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. Journal of Assisted Reproduction and Genetics, 2016, 33(5): 581-588. DOI:10.1007/s10815-016-0710-8 |
| [10] |
Ma H, Marti-Gutierrez N, Park S W, et al. Correction of a pathogenic gene mutation in human embryos. Nature, 2017, 548: 413-419. DOI:10.1038/nature23305 |
| [11] |
Lu Y, Xue J X, Deng T, et al. Safety and feasibility of CRISPRedited T cellsin patients with refractory non-small-cell lung cancer. Nature Medicine, 2020, 26(5): 732-740. DOI:10.1038/s41591-020-0840-5 |
| [12] |
Gillmore J D, Gane E, Taubel J, et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. The New England Journal of Medicine, 2021, 385(6): 493-502. DOI:10.1056/NEJMoa2107454 |
| [13] |
Frangoul H, Altshuler D, Cappellini M D, et al. CRISPR-Cas9 gene editing for sickle cell disease and β-thalassemia. The New England Journal of Medicine, 2021, 384(3): 252-260. DOI:10.1056/NEJMoa2031054 |
| [14] |
Fu Y F, Foden J A, Khayter C, et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature Biotechnology, 2013, 31(9): 822-826. DOI:10.1038/nbt.2623 |
| [15] |
Zuo E W, Cai Y J, Li K, et al. One-step generation of complete gene knockout mice and monkeys by CRISPR/Cas9-mediated gene editing with multiple sgRNAs. Cell Research, 2017, 27(7): 933-945. DOI:10.1038/cr.2017.81 |
| [16] |
Crudele J M, Chamberlain J S. Cas9 immunity creates challenges man-embryo-genome-editing.
|
| [17] |
Haapaniemi E, Botla S, Persson J, et al. CRISPR-Cas9 genome editing induces a p53-mediated DNA damage response. Nature Medicine, 2018, 24(7): 927-930. DOI:10.1038/s41591-018-0049-z |
| [18] |
Ihry R J, Worringer K A, Salick M R, et al. p53 inhibits CRISPR-Cas9 engineering in human pluripotent stem cells. Nature Medicine, 2018, 24(7): 939-946. DOI:10.1038/s41591-018-0050-6 |
| [19] |
Alanis-Lobato G, Zohren J, McCarthy A, et al. Frequent loss of heterozygosity in CRISPR-Cas9-edited early human embryos. PNAS, 2021, 118(22): e2004832117. DOI:10.1073/pnas.2004832117 |
| [20] |
Zuccaro M V, Xu J, Mitchell C, et al. Allele-specific chromosome removal after Cas9 cleavage in human embryos. Cell, 2020, 183(6): 1650-1664. DOI:10.1016/j.cell.2020.10.025 |
| [21] |
Liang D, Gutierrez N M, Chen T L, et al. Frequent gene conversion in human embryos induced by double strand breaks. bioRxiv, 2020. DOI:10.1101/2020.06.19.162214 |
| [22] |
Isasi R, Kleiderman E, Knoppers B M. Editing policy to fit the genome?. Science, 2016, 351: 337-339. DOI:10.1126/science.aad6778 |
| [23] |
National Academy of Sciences, National Academy of Medicine. Human Genome Editing: Science, Ethics, and Governance. Washington DC: National Academies Press, 2017.
|
| [24] |
Ormond K E, Mortlock D P, Scholes D T, et al. Human germline genome editing. The American Journal of Human Genetics, 2017, 101(2): 167-176. DOI:10.1016/j.ajhg.2017.06.012 |
| [25] |
Bioethics N C. Genome Editing and Human Reproduction: Social and Ethical Issues. London: Nuffield Council on Bioethics, 2018.
|
| [26] |
World Health Organization. Human genome editing: A framework for governance. (2021-07-12)[2021-10-25]. https://www.who.int/publications/i/item/9789240030060.
|
| [27] |
World Health Organization. Human genome editing: Recommendations. (2021-07-12)[2021-10-25]. https://www.who.int/publications/i/item/9789240030381.
|
| [28] |
Galvin M. Statement from the Organizing Committee on Reported Human Embryo Genome Editing. (2018-12-26)[2021-03-03]. https://www.nationalacademies.org/news/2018/11/statement-from-the-organizing-committee-onreported-human-embryo-genome-editing.
|
| [29] |
Dzau V J, McNutt M, Bai C L. Wake-up call from Hong Kong. Science, 2018, 362: 1215. DOI:10.1126/science.aaw3127 |
| [30] |
Lander E S, Baylis F, Zhang F, et al. Adopt a moratorium on heritable genome editing. Nature, 2019, 567: 165-168. DOI:10.1038/d41586-019-00726-5 |
| [31] |
Doudna J. CRISPR's unwanted anniversary. Science, 2019, 366: 777. DOI:10.1126/science.aba1751 |
| [32] |
Dryzek J S, Nicol D, Niemeyer S, et al. Global citizen deliberation on genome editing. Science, 2020, 369: 1435-1437. DOI:10.1126/science.abb5931 |
| [33] |
Vassena R, Heindryckx B, Peco R, et al. Genome engineering through CRISPR/Cas9 technology in the human germline and pluripotent stem cells. Human Reproduction Update, 2016, 22(4): 411-419. DOI:10.1093/humupd/dmw005 |
| [34] |
Doudna J A. The promise and challenge of therapeutic genome editing. Nature, 2020, 578: 229-236. DOI:10.1038/s41586-020-1978-5 |
| [35] |
Quétier F. The CRISPR-Cas9 technology: Closer to the ultimate toolkit for targeted genome editing. Plant Science, 2016, 242: 65-76. DOI:10.1016/j.plantsci.2015.09.003 |
| [36] |
James S, Collins F H, Welkhoff P A, et al. Pathway to deployment of gene drive mosquitoes as a potential biocontrol tool for elimination of malaria in sub-Saharan Africa: Recommendations of a scientific working group. The American Journal of Tropical Medicine and Hygiene, 2018, 98(6_Suppl): 1-49. DOI:10.4269/ajtmh.18-0083 |
| [37] |
Breed M F, Harrison P A, Blyth C, et al. The potential of genomics for restoring ecosystems and biodiversity. Nature Reviews Genetics, 2019, 20(10): 615-628. DOI:10.1038/s41576-019-0152-0 |
| [38] |
Lei R P, Zhai X M, Zhu W, et al. Reboot ethics governance in China. Nature, 2019, 569: 184-186. DOI:10.1038/d41586-019-01408-y |
| [39] |
雷瑞鹏, 翟晓梅, 朱伟, 等. 人类基因组编辑: 科学、伦理学与治理. 北京: 中国协和医科大学出版社, 2019.
|
| [40] |
Collins F S, Gottlieb S. The next phase of human gene-therapy oversight. The New England Journal of Medicine, 2018, 379(15): 1393-1395. DOI:10.1056/NEJMp1810628 |




