野生动物一般是指没有经过中、长期人工养殖或驯化的动物[1]。野生动物疫病一般是指病原生物所导致的野生动物出现群体性感染、健康异常和病亡现象,这些病原生物可能来自野生动物本身,也可能来自人、畜禽、宠物等。野生动物携带或感染的病原生物也可导致人、畜禽或宠物产生群体性感染、健康异常和病亡,甚至造成重大公共卫生安全事件。因为人与动物存在进化关系,所以享有共同或类似的病原生物也是很自然、很普遍的。人与野生或家养动物之间可以相互交叉感染、传播的疾病,称人与动物共患疾病(zoonotic diseases);与畜禽有关的,也称人畜共患病。我国野生动物疫病种类众多,涉及病毒、细菌、寄生虫诸多类群,其感染和传播路径复杂多样,对人类健康、禽畜养殖业、珍稀濒危动物保护等均构成重大威胁[2, 3]。据估计,约61% 的人类疾病是人与动物共患疾病;其中,与兽类有关的病毒性人与动物共患疾病中,大约60% 来自鼠类,30% 来自蝙蝠,23% 来自灵长类,21% 来自反刍类,21% 来自食肉类[4]。因此,野生动物疫病事关人类公共卫生安全、畜禽水产养殖安全、生物多样性保护和生态安全。
历史上,野生动物疫病曾给人类带来巨大灾难。例如,鼠疫是由鼠类携带的鼠疫杆菌引起的一种非常危险的人与动物共患疾病,在国内外均被列为甲类传染病。据史料记载,第一次世界鼠疫大流行始于公元541年,第二次世界鼠疫大流行始于公元1347年,第三次世界鼠疫大流行始于1855年。据估计,每次世界鼠疫大流行,死亡人数都达数千万,甚至上亿[5, 6]。1910年,鼠疫在我国东北暴发流行,持续6个多月,造成6万多人死亡。基于现代鼠疫杆菌DNA序列的分析,曾认为鼠疫起源于中国或中国附近[7]。但最近基于鼠疫杆菌古DNA序列的分析表明,鼠疫起源最早可追溯至青铜器时代的欧洲,其中腺鼠疫约在3 800年前起源于欧洲[8]。
近年来,受全球气候变化和人类活动不断加剧的影响,与野生或家养动物有关的重大传染病问题愈演愈烈。据估计,过去20年,发生了10多次全球性疾病大流行,如非典型肺炎(SARS)、甲型流感、新冠肺炎、登革热、寨卡病毒病、埃博拉病毒病、沙拉热、出血热、莱姆病、鼠疫、禽流感、非洲猪瘟等。自2005年以来,甲型H1N1流感疫情(2009年)、埃博拉疫情(2014年、2018—2019年)、寨卡病毒疫情(2016年)、野生型脊髓灰质炎疫情(2014年)和新冠肺炎疫情(2020年)被世界卫生组织(WHO)宣布为“国际关注的突发公共卫生事件”(PHEIC)。研究表明,沙拉热、出血热、莱姆病、鼠疫由鼠类及媒介昆虫传播;登革热、寨卡病毒病由蚊虫传播;甲型流感、非洲猪瘟由家猪及媒介昆虫传播;禽流感由野鸟、家禽传播;疟疾由蚊虫传播;埃博拉、亨德拉、尼帕病毒病可能由蝙蝠、鼠类等传播。SARS病毒、新型冠状病毒与蝙蝠携带的冠状病毒具有很高的同源性[9, 10],但其自然宿主和跨种传播途径尚待查明。迁徙野鸟携带的高致病禽流感病毒H5N1可对人类健康和畜禽养殖业产生重要威胁[11-14]。
2019年底,新冠肺炎疫情暴发,形成全球性大流行。截至2021年1月31日,新冠肺炎疫情在全球已造成1.03亿人感染、220余万人死亡。新冠肺炎疫情进一步加剧了全球经济危机和衰退。2019—2020年,我国同时遭遇新冠肺炎、非洲猪瘟、鼠疫等重大传染病的多重冲击,疫情给人民身体健康、畜牧业生产、经济和社会发展造成了难以估量的损失。因此,加大野生动物疫病的研究与防控,对于保障国家生物安全和生态安全十分必要和迫切。
2 野生动物疫病暴发的原因近年来,造成野生动物疫病暴发、流行和不断加剧的原因很多,但主要有气候变化和人类活动两个方面。
2.1 气候变化不断加剧导致全球性和区域性野生动物疫病频发一般来说,大范围疫病的发生和流行,往往与大尺度气候异常或极端气候有关。厄尔尼诺-南方涛动现象(ENSO)①是影响我国乃至全球气候异常的一个重要的大尺度气候因子。ENSO可改变正常大气循环,影响全球降水和温度分布格局,造成重大气象灾害,并诱发生物灾害。过去50年,随着气候变暖不断加剧,ENSO事件更加频繁[15],这也许是造成近年来全球性重大传染病事件频发的重要原因之一。20世纪90年代,张知彬等[16, 17]提出了“生物灾害ENSO成因说”,认为ENSO通过改变全球大气环流和温度、降水格局,为有害生物种群发生提供了有利的条件,并导致生物灾害频繁出现;Zhang[18]还提出ENSO事件可作为大尺度、超长期生物灾害预警的重要指标。近年来,国内外很多研究结果都证实了ENSO与生物灾害存在密切关系。例如,我国学者相继发现ENSO事件与欧洲的鼠类[19]、中国的鼠类和鼠疫[20-23]及出血热[24]种群或疫病暴发密切关联。在美国,ENSO导致降水变化,增加了白足鼠的种群数量,从而导致美国汉塔病流行[25]。在澳大利亚,ENSO驱动的降水增加,导致鼠类暴发及小型食肉兽数量激增,危及土著珍稀物种的生存[26]。在智利,厄尔尼诺事件伴随降水增加,导致当地鼠类种群暴发[27]。
① 指赤道太平洋东部海水每隔2—7年异常增温(厄尔尼诺)或降温(拉尼娜)的现象,并伴随东南太平洋与印度洋及印尼地区之间出现反相气压振动(南方涛动)。
气候变化对疫病的发生通常具有复杂作用,与宿主、病原、栖息环境、人体免疫等特点有关。例如,登革热多发生在暖湿的夏季[28],而流感则易发生在干冷的冬季[29],且流感病毒在冬季传播速度更快[30]。气候对新冠病毒传播的影响结论尚不明确[31]。有研究表明,新型冠状病毒传播可能与温度有负相关关系[32-34],但其最大传染力可能有最适温度范围[33]。高降水有利于干旱地区鼠疫的发生,而干旱却有利于湿润地区鼠疫的发生[5]。近百余年来,全球平均气温不断上升,气候变暖不断加剧。气候变暖可导致动物疫病从低纬度、低海拔向高纬度、高海拔地区扩张。有研究表明,近年来,气候变暖导致了登革热病毒及其宿主从亚热带传播至我国的北方,甚至西藏[35]。原来分布在南方的黄胸鼠,已扩散至我国北方,加大了鼠疫发生的风险[36]。然而,气候变冷也会增加疫病发生的概率。例如,千年尺度上,气候变冷增加了我国历史上各类自然灾害(包括疫病)发生的频次。这可能是由于极端冷气候导致农业歉收、饥荒盛行、社会动乱、人体免疫力下降,使人们更容易感染和传播疾病[37]。因此,气候变化对疫病的影响可能具有不同路径、作用相反的非单调特征[38]。
2.2 人类活动不断加剧导致全球性或区域性野生动物疫病频发工业革命以来,人类活动对地球生态系统影响巨大。2016年,世界人口数量已经达到72.6亿,全球40% 的土地已经被开垦为农业、工业等用地。随着经济社会的快速发展,交通运输四通八达,人员和货物流动频繁,养殖业不断壮大,经济全球化水平日益提升。2019年,据英国著名科学杂志《自然》杂志报道,一组科学家投票选出了一个新的地质时代——人类世。人类世对现代疫病暴发、流行和传播产生了深刻影响。
生物多样性减少、生态系统紊乱可能会增加一些疾病发生的概率。通常,病原和宿主的多样性是正相关的[39-41]。因此,宿主生物多样性越高的地区(如热带、亚热带)或类群(如鼠类),其病原的种类也就越丰富,相关疾病发生的风险也越高,这可以解释为什么新发疾病多始于热带或亚热带地区。但在人类活动加剧下,由于土地利用、滥捕滥猎等,导致生物多样性丧失,动物疫病发生风险也会增加[42-44]。2014年,Dirzo等[45]提出“群落丢失理论”(defaunation hypothesis),认为:全球生物多样性丧失导致大型动物群落丢失,并使鼠类种群密度增加,进而加大了鼠传疫病发生的机会。也有人提出“稀释假说”(dilute hypothesis),认为宿主多样性增加,可以减少疫病发生的风险,而生物多样性下降则增加疫病发生的风险[46-48];根据文献回溯和大数据分析,有研究支持该假说[49],但是也有研究不支持[50, 51]。最近的一项研究发现,疾病发生与生物多样性存在尺度依赖的非单调性关系:小空间尺度存在稀释作用(dilute effect),大空间尺度存在放大效应(amplification effect)[52]。Sun等[53]发现我国鼠疫发生频次与鼠类多样性有正相关关系,支持放大效应假说。
人与动物接触更加密切、交通运输更加发达,也加剧了野生动物疫病的发生和传播。非法动物捕猎和贸易会增加接触病原生物的机会,加大人群感染动物疫病的风险[54]。发达的交通网、物联网和互联网,加快了人流和物流的速度,继而也加速了动物疫病全球性扩散和传播[55]。例如,Cheng等[30]发现以人类为主要宿主的H1N1、H3N2病毒要比以野鸟、畜禽为主要宿主的H5N1、H7N9病毒传播得更远、更快。Xu等[56]发现道路、河流等交通促进了我国历史上鼠疫的传播。全球畜禽养殖业和宠物饲养业的不断发展和壮大,增加了暴发人与动物共患疾病的概率。研究表明,人与动物共患疾病往往随着动物驯化时间的增加而增加[57]。当前,过度追求高效、低成本的速成、高密度、集约化的饲养模式易降低动物免疫力,导致动物易感疾病,进而导致养殖业过度依赖抗生素。据统计,约50% 的人与兽类共患疾病来自12种家畜[4]。2009年全球人群暴发的甲型H1N1流感病毒来自家猪[58]。2020年,新型冠状病毒在欧美水貂养殖场接连暴发,对欧美水貂养殖业造成重大打击[59, 60]。非洲猪瘟病毒对全球多国的养猪业造成毁灭性打击;目前,多国(包括我国多地)已发现野猪感染该病毒[61]。我国多起大熊猫死亡事件与犬瘟热感染有关[62]。由此可见,现代社会下,人员交往频繁、货物流动加快、养殖动物密度过高、人与动物接触过密、生态系统紊乱是疫病日益严重的关键因素。
2.3 小结综上,影响野生动物疫病发生的因素和路径很多(图 1)。归纳起来,外部驱动因素方面,主要是气候变化和人类活动,其可直接地或间接地影响疫源动物、媒介、病原。内部因素方面,主要是疫源动物、媒介、病原和人类之间的相互作用与传播。因此,加强野生动物疫病研究与防控,既要加大对气候变化和人类活动对疫病暴发、流行规律和机制的研究,也要加大对疫源动物、媒介、病原和人类之间的传播规律和机制的研究,从而寻找野生动物疫病控制的方法和途径。
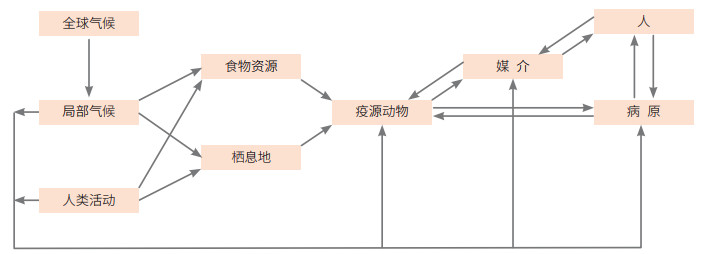
|
| 图 1 影响野生动物疫病发生的关键因素和路径 Figure 1 Key factors and pathways affecting outbreaks of wildlife infectious diseases |
我国很早就认识到野生动物与人类传染病的关系。例如,清代诗人师道南在《鼠死行》一首诗中,首次记载了鼠疫与死鼠的关系。新中国成立后,通过采取查清鼠疫疫源地、监测鼠密度和开展“灭鼠拔源”等措施,我国成功地控制了曾严重危害人民健康百年的鼠疫灾害;此外,通过大力推广爱国卫生运动和应用疾病控制新技术,许多动物源性的疫病(如疟疾、各类寄生虫病等)都得到了较好控制。
但是,20世纪80年代以来,全球新发突发重大传染病不断涌现,对公共卫生安全、畜牧业生产和生态安全构成了严重挑战和威胁。由于许多疫病的跨种传播或起源都与野生动物有关,因而急需构建我国野生动物防疫体系,以有效地协同我国卫生和农业防疫体系开展疫病防控工作。
2002—2003年非典型肺炎疫情暴发后,在中国科学院动物研究所的建议和推动下,国家林业局(现“国家林业和草原局”)和中国科学院联合提出构建全国陆生野生动物疫源疫病监测体系的建议,得到了国务院的批准,并由国家发展和改革委员会、财政部拨专款支持该体系的建设和运转。2005年3月15日,国家林业局主持召开首次全国野生动物疫源疫病监测工作电话会议。2005年12月8日,国家林业局挂牌成立了国家林业局野生动物疫源疫病监测总站,负责全国野生动物疫源疫病监测工作。由此,我国野生动物疫源疫病监测正式拉开帷幕。2013年1月31日,国家林业局发布《陆生野生动物疫源疫病监测防控管理办法》,对陆生野生动物疫源、疫病给出明确界定:陆生野生动物疫源是指携带危险性病原体,危及野生动物种群安全,或者可能向人类、饲养动物传播的陆生野生动物;陆生野生动物疫病是指在陆生野生动物之间传播、流行,对陆生野生动物种群构成威胁或者可能传染给人类和饲养动物的传染性疾病。该办法还对监测范围、内容、规范和要求等做了明确规定。
截至目前,依托国家林业和草原局系统,我国已建立了742处国家级陆生野生动物疫源疫病监测站、1 000余处省级监测站和一大批市县级监测站;构建了陆生野生动物疫源疫病监测体系,在我国野生动物疫病,如高致病性禽流感、非洲猪瘟、犬瘟热等,预警和防控上发挥了重要作用。与此同时,我国在一些新发野生动物疫病相关病原诊断[9-14],以及应用无人机、互联网和人工智能开展动物监测方面也取得了显著的进展[63-66]。我国的一些科研单位和部门初步建立了10多个野生动物红外相机监测平台或网络,积累了许多监测数据[67, 68]。
但是,由于我国陆生野生动物疫病监测体系建设起步较晚,基础条件和人员队伍相对薄弱。2018年,任钟毓等[69]通过问卷调查的方式收集和分析了我国31个省(自治区、直辖市)的343个国家级监测站的数据和资料,发现这些国家级监测站普遍存在“专业人员短缺、基础设备不健全、资金不足”等问题,并据此提出了“加强监测队伍能力建设、加大资金投入、增强科学技术的使用”等对策与建议。因此,面对日益严重的野生动物疫病重大挑战和威胁,急需加强和提升我国野生动物疫病研究、监测、诊断、预警、防控等方面的综合能力。
4 加强野生动物疫病监测与防控的对策和建议 4.1 对策(1)突破传统“公共卫生”理念,将疫病监测与防控扩展到“生态健康”层面。过去,我国卫生防疫系统比较侧重人的健康和疾病问题,而农业防疫系统则比较侧重养殖动物的健康和疫病问题。当前,疫病发生和防控问题涉及人、野生动物和家养动物,以及受气候和环境多因素、多路径、复杂交互影响。因此,疫病防控对策要从人或动物的健康拓展到“生态健康”的层面,全面考察人、畜禽、野生动物疾病之间及其与气候、环境的关系。
(2)加强疫源生物监测,加强环境与气候变化对疫病暴发影响研究,提升疫病发生的预测能力。全球性和区域性疫病大流行,往往受大尺度气候和环境变化的影响。掌握气候和环境变化对疾病发生和流行影响的规律,对于提前疫病预警,采取预防措施,降低疫病暴发和流行的危害至关重要。
(3)减少人、畜禽、宠物与野生动物接触,切断跨物种传播链条。绝大多数新发、再发传染病来自家养动物和野生动物,且病原体可在人、家养动物、野生动物之间相互传播和演化。因此,切断人、家养动物、野生动物之间病原和媒介传播链条,对于大幅减少或降低疫病发生风险至关重要。要加强对养殖区的封闭管理和检疫,尽可能减少养殖区与人、野生动物、家养动物的接触和交叉感染。要改善养殖环境和条件,增强家养动物的免疫力。要对宠物进行必要的免疫,对居住区附近的疫源野生动物(包括野化的家养动物)进行监测、控制或免疫。严格禁止和打击对野生动物的非法狩猎、交易和滥食,严禁游客进入自然保护区核心区和接触野生动物,避免疫病交叉感染和传播。
(4)加强对疫源动物、媒介和疫源地的治理,减少疫病发生风险。对疫病防控,只是监测是不够的,还需要对疫源风险进行干预和控制。例如,美国向野外投放口服狂犬病疫苗,降低野生动物狂犬病感染率,从而减少其对家养动物传播的机会。我国有10多种类型的鼠疫自然疫源地,分布于19个省(自治区、直辖市)的278个县,疫源面积达100多万平方公里,时刻威胁疫源地人民健康安全。因此,需要加大我国农业、林业、牧业鼠类种群密度的监测和控制力度,切断鼠疫传播链条。此外,还要摸清自然界高致病性禽流感、狂犬病、非洲猪瘟、口蹄疫、布病、包虫病、出血热、恙虫病、登革热等重大人畜共患病的疫源野生动物、媒介和疫源地,并开展监测和治理。
4.2 建议为应对全球变化下日益严重的野生动物疫病威胁,全面落实即将实施的《中华人民共和国生物安全法》,需要进一步提升我国现有的陆生野生动物疫源疫病监测体系。为此,建议在“十四五”期间,依托国家、地方有关部门及相关科研机构、大学、企业等,重点加强和支持如下8个方面的工作。
(1)完善监测站点布局和队伍建设,提升基层监测和防控水平与能力。根据疫源动物、媒介动物和病原生物及自然疫源地的分布特点,调整、补充和完善国家、省、县三级监测网络和站点。配备先进的用于野外监测、样品收集、样品贮存、病原诊断、疫情干预、信息整理等物资、设备和条件。加强基层队伍建设和人员培训与指导。
(2)制定重要疫源生物清单,查清自然疫源地并开展规模化治理。近年来,受全球气候变化和人类活动加剧的影响,动物分布区发生了快速变化,需要尽快开展新一轮全国摸底调查;并结合国际资料,制定我国重要疫源动物、媒介动物和病原生物物种清单及自然疫源地区划,查清疫源地,开展规模化治理。同时,对疫源性的珍稀、濒危、有益物种进行保护,避免人、家养动物接触。
(3)提升疫源动物、媒介和疫病的监测技术、信息化和预警预报能力。制定和完善标准化的监测方法、数据采集和处理模式,采用物联网、大数据、人工智能、云计算、卫星定位等高精尖技术手段,构建覆盖全国各站点的自动智能化监测网络,实现疫源动物、媒介、疫病大数据实时监测和预警,以期在疫情分析、病原溯源、防控干预、资源调配等方面发挥支撑作用。
(4)提升野生动物疫病快速诊断、海量筛查和风险发现的能力。鉴于野生动物病原生物种类多、样品多、变异大的特点,现有监测方法、试剂、设备难以满足野生动物疫源疫病监测的需求,需要建立和完善适合野生动物疫病的病原监测、诊断方法和体系。针对潜在风险病原,需建立基于宏基因组、环境基因组分析的病原快速、海量筛查方法和体系。
(5)提升野生动物疫病研究水平和能力。建立或支持一批国家、区域研究中心和参考实验室,以支撑野生动物疫源疫病的监测和防控所需的技术和分析。布局保护生物学与野生动物疫病国家重点实验、国家疫源生物数据库和样本库,加强有害生物控制研究领域的国家重点实验建设,启动一批野生动物疫病相关的国家和部门级重大研究计划或项目。充分利用我国已有的生物安全实验室平台布局,促进资源与平台共享,提升防控监测和干预能力。
(6)扶持诊断试剂与仪器、防控药物与设备、自动智能监测设备、安全防护设施等相关产业发展。野生动物疫病监测与防控技术的产业化,有利于我国生物产业和装备产业的发展。建立或完善野生动物疫病监测与防控产品标准及行业体系,鼓励和扶持一批企业开展技术、产品研发和产业化。
(7)加强科普宣传和教育,提高全民野生动物疫病防范意识。野生动物疫病监测与防控是一个复杂系统,涉及人、动物、气候、环境多个因素,需要提高全民野生动物疫病防控的意识,吸引全民参与重大疫情的监测、预警和防控。鼓励和支持各基层站点定期开展科普宣传和教育,以减少群众感染疫病的机会,阻断疫病传播链条。
(8)加强国际合作与交流,建立国际野生动物疫病联防联控机制。随着国家之间货物、人员交流的不断加快,加强国际合作,建立全球化的疫病监测、联防联控机制十分必要。国际上,与野生动物疫病有关的国际组织不多,且大多侧重学术性研究,政府层面上的协同能力比较薄弱。建议我国积极推动国际野生动物疫病监测与防控组织或联盟的创建,建立标准化的监测网络、诊断标准、防控方法、信息共享和技术交流,以及与世界卫生组织、世界动物卫生组织(OIE)等国际组织交流与合作机制。同时,积极协助做好“一带一路”沿线国家和地区野生动物疫病联防联控工作,推进全球生物安全和生态安全目标和战略的实施。
| [1] |
曾岩, 平晓鸽, 魏辅文. "野生动物"的概念框架和术语定义. 生物多样性, 2020, 28(5): 541-549. |
| [2] |
夏咸柱, 高宏伟, 华育平. 野生动物疫病学. 北京: 高等教育出版社, 2011.
|
| [3] |
何宏轩, 王承民, 秦建华, 等. 野生动物疫病学概论. 北京: 科学出版社, 2014.
|
| [4] |
Johnson C K, Hitchens P L, Pandit P S, et al. Global shifts in mammalian population trends reveal key predictors of virus spillover risk. Proceedings of the Royal Society B: Biological Sciences, 2020, 287: 20192736. DOI:10.1098/rspb.2019.2736 |
| [5] |
Xu L, Liu Q, Stige L C, et al. Nonlinear effect of climate on plague during the third pandemic in China. PNAS, 2011, 108: 10214-10219. DOI:10.1073/pnas.1019486108 |
| [6] |
Xu L, Stige L C, Leirs H, et al. Historical and genomic data reveal the influencing factors on global transmission velocity of plague during the Third Pandemic. PNAS, 2019, 116: 11833-11838. |
| [7] |
Morelli G, Song Y, Mazzoni C J, et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity. Nature Genetics, 2010, 42: 1140-1143. DOI:10.1038/ng.705 |
| [8] |
Spyrou M A, Tukhbatova R I, Wang C C, et al. Analysis of 3800-year-old Yersinia pestis genomes suggests Bronze Age origin for bubonic plague. Nature Communications, 2018, 9: 2234. DOI:10.1038/s41467-018-04550-9 |
| [9] |
Li W, Shi Z, Yu M, et al. Bats are natural reservoirs of SARSlike coronaviruses. Science, 2005, 310: 676-679. DOI:10.1126/science.1118391 |
| [10] |
Zhou P, Yang X L, Wang X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020, 579: 270-273. DOI:10.1038/s41586-020-2012-7 |
| [11] |
Liu J, Xiao H, Lei F, et al. Highly pathogenic H5N1 influenza virus infection in migratory birds. Science, 2005, 309: 1206. DOI:10.1126/science.1115273 |
| [12] |
Olsen B, Munster V J, Wallensten A, et al. Global patterns of influenza a virus in wild birds. Science, 2006, 312: 384-388. DOI:10.1126/science.1122438 |
| [13] |
Li Y, Liu L, Zhang Y, et al. New avian influenza virus (H5N1) in wild birds, Qinghai, China. Emerging Infectious Diseases, 2011, 17: 265-267. DOI:10.3201/eid1702.100732 |
| [14] |
Zhang Y, Zhang Q, Kong H, et al. H5N1 hybrid viruses bearing 2009/H1N1 virus genes transmit in guinea pigs by respiratory droplet. Science, 2013, 340: 1459-1463. DOI:10.1126/science.1229455 |
| [15] |
Zhang Q, Guan Y, Yang H. ENSO amplitude change in observation and coupled models. Advances in Atmospheric Sciences, 2008, 25: 361-366. DOI:10.1007/s00376-008-0361-5 |
| [16] |
张知彬. 生物灾害可能与厄尔尼诺现象有关//走向21世纪的中国生态学. 北京: 中国科学技术出版社, 1995: 232-233.
|
| [17] |
张知彬, 王祖望. ENSO现象与生物灾害. 中国科学院院刊, 1998, 13(1): 34-38. DOI:10.3969/j.issn.1000-3045.1998.01.008 |
| [18] |
张知彬. 厄尔尼诺与大尺度、超长期生物灾害预警. 科学, 1999, 51(1): 34-36. |
| [19] |
Zhang Z B. Relationship between El Niño/South Oscillation (ENSO) and population outbreaks of some lemmings and voles in Europe. Chinese Science Bulletin, 2001, 46: 1067-1073. DOI:10.1007/BF02900679 |
| [20] |
Zhang Z, Pech R, Davis S, et al. Extrinsic and intrinsic factors determine the eruptive dynamics of Brandt's voles Microtus brandti in Inner Mongolia, China. Oikos, 2003, 100: 299-310. DOI:10.1034/j.1600-0706.2003.11810.x |
| [21] |
Zhang Z, Li Z, Tao Y, et al. Relationship between increase rate of human plague in China and global climate index as revealed by cross-spectral and cross-wavelet analyses. Integrative Zoology, 2007, 2: 144-153. DOI:10.1111/j.1749-4877.2007.00061.x |
| [22] |
Zhang Z, Xu L, Guo C, et al. Effect of ENSO-driven precipitation on population irruptions of the Yangtze vole Microtus fortis calamorum in the Dongting Lake region of China. Integrative Zoology, 2010, 5: 176-184. DOI:10.1111/j.1749-4877.2010.00199.x |
| [23] |
Jiang G, Zhao T, Liu J, et al. Effects of ENSO-linked climate and vegetation on population dynamics of sympatric rodent species in semiarid grasslands of Inner Mongolia, China. Canadian Journal of Zoology, 2011, 89: 678-691. DOI:10.1139/z11-048 |
| [24] |
Tian H, Yu P, Cazelles B, et al. Interannual cycles of Hantaan virus outbreaks at the human-animal interface in Central China are controlled by temperature and rainfall. PNAS, 2017, 114: 8041-8046. DOI:10.1073/pnas.1701777114 |
| [25] |
Hjelle B, Glass G E. Outbreak of Hantavirus infection in the Four Corners region of the United States in the wake of the 1997-1998 El Nino-southern oscillation. Journal Of Infectious Diseases, 2000, 181: 1569-1573. DOI:10.1086/315467 |
| [26] |
Letnic M, Dickman C R. Boom means bust: interactions between the El Niño/Southern Oscillation (ENSO), rainfall and the processes threatening mammal species in arid Australia. Biodiversity & Conservation, 2006, 15: 3847-3880. DOI:10.1007/s10531-005-0601-2 |
| [27] |
Lima M, Marquet P A, Jaksic F M. El Niño events, precipitation patterns, and rodent outbreaks are statistically associated in semiarid Chile. Ecography, 1999, 22: 213-218. DOI:10.1111/j.1600-0587.1999.tb00470.x |
| [28] |
Xu L, Stige L C, Chan K S, et al. Climate variation drives dengue dynamics. PNAS, 2017, 114: 113-118. DOI:10.1073/pnas.1618558114 |
| [29] |
Lowen A C, Mubareka S, Steel J, et al. Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathogens, 2007, 3(10): 1470-1476. |
| [30] |
Cheng C, Li J, Liu W, et al. Modeling analysis revealed the distinct global transmission patterns of influenza A viruses and their influencing factors. Integrative Zoology, 2020. DOI:10.1111/1749-4877.12469 |
| [31] |
National Academies of Sciences. Rapid Expert Consultation on SARS-CoV-2 Survival in Relation to Temperature and Humidity and Potential for Seasonality for the COVID-19 Pandemic (April 7, 2020). Washington DC: The National Academies Press, 2020: 8.
|
| [32] |
Qi H, Xiao S, Shi R, et al. COVID-19 transmission in Mainland China is associated with temperature and humidity: A time-series analysis. Science of the Total Environment, 2020, 728: 138778. DOI:10.1016/j.scitotenv.2020.138778 |
| [33] |
Wan X, Cheng C, Zhang Z. Early transmission of COVID-19 has an optimal temperature but late transmission decreases in warm climate. medRxiv, 2020. DOI:10.1101/2020.05.14.20102459 |
| [34] |
Wang J, Tang K, Feng K, et al. High temperature and high humidity ueduce the transmission of COVID-19. SSRN Electronic Journal, 2020. DOI:10.2139/ssrn.3551767 |
| [35] |
Liu Q, Liu X, Cirendun Z, et al. Mosquitoes established in Lhasa City, Tibet, China. Parasites & Vectors, 2013, 6: 224. |
| [36] |
张美文, 郭聪, 王勇. 我国黄胸鼠的研究现状. 动物学研究, 2000, 21(6): 487-497. DOI:10.3321/j.issn:0254-5853.2000.06.013 |
| [37] |
Tian H, Yan C, Xu L, et al. Scale-dependent climatic drivers of human epidemics in ancient China. PNAS, 2017, 114: 12970-12975. DOI:10.1073/pnas.1706470114 |
| [38] |
Zhang Z, Yan C, Krebs C J, et al. Ecological non-monotonicity and its effects on complexity and stability of populations, communities and ecosystems. Ecological Modelling, 2015, 312: 374-384. DOI:10.1016/j.ecolmodel.2015.06.004 |
| [39] |
Hechinger R F, Lafferty K D. Host diversity begets parasite diversity: Bird final hosts and Trematodes in snail intermediate hosts. Proceedings of Biological Sciences, 2005, 272: 1059-1066. |
| [40] |
Poulin R. Parasite biodiversity revisited: Frontiers and constraints. International Journal for Parasitology, 2014, 44: 581-589. DOI:10.1016/j.ijpara.2014.02.003 |
| [41] |
Johnson P T J, Wood C L, Joseph M B, et al. Habitat heterogeneity drives the host-diversity-begets-parasitediversity relationship: Evidence from experimental and field studies. Ecology Letters, 2016, 19: 752-761. DOI:10.1111/ele.12609 |
| [42] |
Patz J A, Daszak P, Tabor G M, et al. Unhealthy landscapes: Policy recommendations on land use change and infectious disease emergence. Environmental Health Perspectives, 2004, 112: 1092-1098. DOI:10.1289/ehp.6877 |
| [43] |
Dirzo R, Young H S, Galetti M, et al. Defaunation in the Anthropocene. Science, 2014, 345: 401. DOI:10.1126/science.1251817 |
| [44] |
Loh E H, Zambrana-Torrelio C, Olival K J, et al. Targeting transmission pathways for emerging zoonotic disease surveillance and control. Vector-Borne and Zoonotic Diseases, 2015, 15: 432-437. DOI:10.1089/vbz.2013.1563 |
| [45] |
Dirzo R, Young H S, Galetti M, et al. Defaunation in the anthropocene. Science, 2014, 345: 401-406. DOI:10.1126/science.1251817 |
| [46] |
LoGiudice K, Ostfeld R S, Schmidt K A, et al. The ecology of infectious disease: Effects of host diversity and community composition on Lyme disease risk. PNAS, 2003, 100: 567-571. DOI:10.1073/pnas.0233733100 |
| [47] |
Keesing F, Holt R D, Ostfeld R S. Effects of species diversity on disease risk. Ecology Letters, 2006, 9: 485-498. DOI:10.1111/j.1461-0248.2006.00885.x |
| [48] |
Keesing F, Belden L K, Daszak P, et al. Impacts of biodiversity on the emergence and transmission of infectious diseases. Nature, 2010, 468: 647-652. DOI:10.1038/nature09575 |
| [49] |
Civitello D J, Cohen J, Fatima H, et al. Biodiversity inhibits parasites: Broad evidence for the dilution effect. PNAS, 2015, 112: 8667-8671. DOI:10.1073/pnas.1506279112 |
| [50] |
Randolph S E, Dobson A D. Pangloss revisited: A critique of the dilution effect and the biodiversity-buffers-disease paradigm. Parasitology, 2012, 139: 847-863. DOI:10.1017/S0031182012000200 |
| [51] |
Salkeld D J, Padgett K A, Jones J H. A meta-analysis suggesting that the relationship between biodiversity and risk of zoonotic pathogen transmission is idiosyncratic. Ecology Letters, 2013, 16: 679-686. DOI:10.1111/ele.12101 |
| [52] |
Halliday F W, Rohr J R. Measuring the shape of the biodiversity-disease relationship across systems reveals new findings and key gaps. Nature Communications, 2019, 10: 5032. DOI:10.1038/s41467-019-13049-w |
| [53] |
Sun Z, Xu L, Schmid B V, et al. Human plague system associated with rodent diversity and other environmental factors. Royal Society Open Science, 2019, 6: 190216. DOI:10.1098/rsos.190216 |
| [54] |
Young H S, McCauley D J, Galetti M, et al. Patterns, Causes, and consequences of anthropocene defaunation. Annual Review of Ecology, Evolution, and Systematics, 2016, 47: 333-358. DOI:10.1146/annurev-ecolsys-112414-054142 |
| [55] |
Krammer F, Smith G J D, Fouchier R A M, et al. Influenza. Nature Reviews Disease Primers, 2018, 4(1): 1-21. |
| [56] |
Xu L, Stige L C, Kausrud K L, et al. Wet climate and transportation routes accelerate spread of human plague. Proceedings of Biological Sciences, 2014, 281: 20133159. |
| [57] |
Morand S, McIntyre K M, Baylis M. Domesticated animals and human infectious diseases of zoonotic origins: Domestication time matters. Infection, Genetics and Evolution, 2014, 24: 76-81. DOI:10.1016/j.meegid.2014.02.013 |
| [58] |
Vijaykrishna D, Poon L L, Zhu H C, et al. Reassortment of pandemic H1N1/2009 influenza A virus in swine. Science, 2010, 328: 1529. DOI:10.1126/science.1189132 |
| [59] |
Enserink M. Coronavirus rips through Dutch mink farms, triggering culls. Science, 2020, 368: 1169. DOI:10.1126/science.368.6496.1169 |
| [60] |
Shuai L, Zhong G, Yuan Q, et al. Replication, pathogenicity, and transmission of SARS-CoV-2 in minks. National Science Review, 2020. DOI:10.1093/nsr/nwaa291 |
| [61] |
裴洁, 胡智斌, 谢军, 等. 湖北省神农架林区野猪非洲猪瘟疫情的紧急流行病学调查. 中国动物检疫, 2021, 38(1): 1-7. |
| [62] |
赵鹏鹏, 韩学利, 沈洁娜, 等. 大熊猫犬瘟热的诊治及预防对策. 动物医学进展, 2017, 38(9): 115-118. DOI:10.3969/j.issn.1007-5038.2017.09.023 |
| [63] |
曾娟, 韩立亮, 郭永旺, 等. 基于大数据的物联网智能监测系统在农区鼠害监测中的应用效果初报. 中国植保导刊, 2019, 39(7): 28-35. |
| [64] |
王天明, 冯利民, 杨海涛, 等. 东北虎豹生物多样性红外相机监测平台概述. 生物多样性, 2020, 28(9): 1059-1066. |
| [65] |
He G, Yang H, Pan R, et al. Using unmanned aerial vehicles with thermal-image acquisition cameras for animal surveys: A case study on the Sichuan snub-nosed monkey in the Qinling Mountains. Integrative Zoology, 2020, 15(1): 79-86. DOI:10.1111/1749-4877.12410 |
| [66] |
Shi C, Liu D, Cui Y, et al. Amur tiger stripes: Individual identification based on deep convolutional neural network. Integrative Zoology, 2020, 15(6): 461-470. DOI:10.1111/1749-4877.12453 |
| [67] |
肖治术, 李学友, 向左甫, 等. 中国兽类多样性监测网的建设规划与进展. 生物多样性, 2017, 25(3): 237-245. |
| [68] |
李晟. 中国野生动物红外相机监测网络建设进展与展望. 生物多样性, 2020, 28(9): 1045-1048. |
| [69] |
任钟毓, 王博宇, 谢屹, 等. 我国国家级陆生野生动物疫源疫病监测站体系建设现状及发展对策研究. 林业经济, 2018, 40(1): 98-101. |



