2. 自然资源部第三海洋研究所 福建省海洋生态保护与修复重点实验室 厦门 361005;
3. 自然资源部海峡西岸海岛海岸带生态系统野外科学观测研究站 厦门 361005
2. Fujian Provincial Key Laboratory of Marine Ecological Conservation and Restoration, Third Institute of Oceanography, Ministry of Natural Resources, Xiamen 361005, China;
3. Observation and Research Station of Island and Coastal Ecosystems in the Western Taiwan Strait, Ministry of Natural Resources, Xiamen 361005, China
工业革命以来,二氧化碳(CO2)等温室气体的排放量骤增,全球气候日渐变暖,自然灾害频发[1]。作为《巴黎协定》的缔约方之一,中国一直都是全球气候治理的中坚力量。2020年,中国国家主席习近平向世界宣布,中国“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。同年,党的十九届五中全会进一步提出“守住自然生态安全边界”的新要求,做出“提升生态系统质量和稳定性”的新部署,体现了我国积极应对全球气候变化的决心和负责任大国的担当。要实现碳中和,“减排”(减少向大气排放CO2)与“增汇”(增加对大气CO2的吸收)同等重要;然而,相对于减排,人们对于增汇的手段及方式仍缺乏重视。以往的增汇主要依赖陆地生态系统(如植树造林等),但随着人口增长与土地及粮食短缺之间的冲突愈演愈烈,储存了地球系统碳总量93% 的海洋,其承担“负排放”的能力正在被重新审视[2]。
珊瑚礁是生物多样性最高的海洋生态系统,在全球尺度上预计每年可固定9亿吨碳[3]。海洋中来自珊瑚礁的初级生产力高达300—5 000 g C·m−2·a−1,而非珊瑚礁系统只贡献50—600 g C·m−2·a−1 [4]。虽然珊瑚礁潜在的碳汇功能早已被发现[5, 6],但由于其钙化过程伴随CO2释放,珊瑚礁在很长时间内被定义为碳源属性[7]。目前,珊瑚礁的碳源/碳汇属性仍然存在争议,还没有被纳入以滨海湿地生态系统(如红树林、盐沼、海草床等)为代表的海岸带蓝碳收支中[8]。因此,厘清珊瑚礁生态系统的“源-汇”机制、探索将珊瑚礁由碳源向碳汇转变的生态调控方式和途径,是当前最为紧迫的珊瑚礁生态修复之举,也是服务好国家碳中和目标与绿色发展战略的应有之义。
1 全球变化对珊瑚礁生态系统的影响珊瑚礁被誉为“海洋中的热带雨林”,是生产力(即通过固定CO2生成有机物)最高的海洋生态系统,在全球碳循环中扮演着重要角色。珊瑚礁生态系统的超强生产力主要依赖与珊瑚共生、隶属虫黄藻科(Symbiodiniaceae)的光合作用甲藻(统称为虫黄藻,Zooxanthellae)[9, 10]。虫黄藻可以将高达95% 的光合作用产物(如糖类、氨基酸、氧气等)提供给珊瑚宿主以满足其生长和钙化所需,珊瑚则将CO2、氮、磷等代谢废物提供给虫黄藻作为养分[11]。
然而,珊瑚礁又是最脆弱的海洋生态系统,对环境变化十分敏感。工业革命以来,温室气体的大量排放、沿岸经济的迅速发展,以及人类不断地向海索地和对资源的过度开发,导致气候变暖、海洋酸化、海平面上升等一系列生态问题的涌现。这些生态问题使得全球近1/3的造礁珊瑚濒临灭绝,珊瑚礁生态系统持续退化,珊瑚“白化”频度且严重度不断上升[12]。珊瑚白化是珊瑚受到外界环境胁迫时将水螅体内的共生虫黄藻大量排出、失去其颜色而呈现苍白甚至完全透明的一种应激状态,如果得不到及时缓解,最终将引起珊瑚的大面积死亡甚至灭绝。全球变暖导致的海水升温,使得著名的澳大利亚大堡礁自1980年有观测记录数据以来经历了3次超大规模白化事件[13]。印度洋和太平洋交汇区域的珊瑚礁三角区也经历了严重衰退。例如,菲律宾造礁珊瑚覆盖率在过去10年间下降了近1/3[14]。我国海南岛西北部、广西涠洲岛也于2020年发生规模及程度都堪称“史上罕见”的大面积珊瑚白化,推断珊瑚死亡率在86% 以上,仍保有水螅体的珊瑚不到20%[15]。日益严重的环境压力不仅威胁到珊瑚礁的生存,也加大了人们对珊瑚礁碳“源- 汇”问题的判断难度。因此,加强珊瑚礁的生态修复,提高其对环境胁迫的弹性适应,维持其潜在的碳汇功能,是当前亟待解决的科学难题。
2 珊瑚礁碳“源-汇”争议海—气CO2分压差是决定某一海区为大气CO2的源或汇的关键因子[16]。珊瑚礁“源-汇”属性的争议由来已久,具体表现为争论其为净源[17-19]、净汇[5, 6, 20]或在源-汇间进行转变[21, 22]。这主要归因于不同珊瑚礁区物理、化学、生物过程的复杂性,导致碳通量与碳收支核算难以统一[6, 7]。珊瑚礁区的碳通量变化主要受有机碳代谢(即光合作用与呼吸作用)和无机碳矿化(即碳酸钙的沉淀与溶解)这两个过程的协同调控(图 1)。珊瑚礁区的有机碳代谢效率极高,其净生产力约为(0 ± 0.7)g C·m−2·d−1 [23],即光合作用固定的CO2几乎全部被利用,因此珊瑚礁区的CO2通量可能主要受无机碳矿化的调控——即珊瑚钙化、溶解过程中伴随的净CO2释放[24]。经推算,沉淀1 mol CaCO3(碳酸钙),经海水缓冲作用,约会释放0.6 mol CO2至大气[7]。但使用H14CO3–和45Ca双标记技术对无机碳来源及转运进行示踪的结果表明:造礁珊瑚钙化过程所利用溶解无机碳的70%—75%来自珊瑚共生体内的代谢[25]。这与“呼吸释放的CO2并非全部释放到大气,还可以用来形成CaCO3骨骼”的推论相吻合[26],说明有机碳代谢也可以是净汇。此外,珊瑚共生体内的初级生产力还可能因为受到CO2的限制而未完全展现[27]。因此,在判断珊瑚礁区群落代谢的净CO2通量时,需考虑共生体内净有机碳代谢和净无机碳矿化的相对贡献[28]。
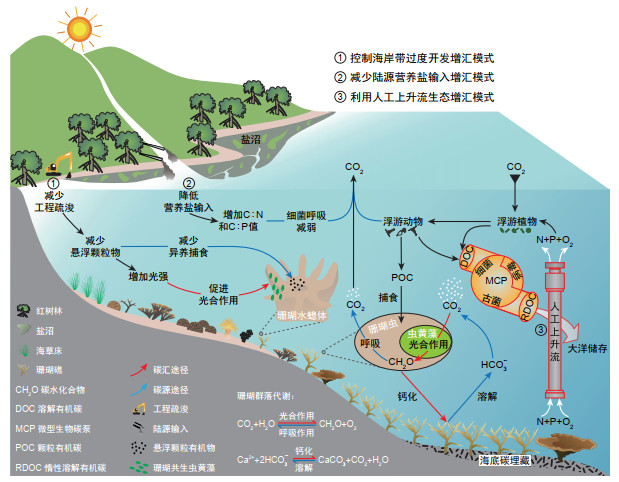
|
| 图 1 珊瑚礁生态系统增汇模式及途径示意图 Figure 1 Schematic illustration of modes and pathways of enhancing carbon sequestration in coral reef ecosystems |
值得注意的是,珊瑚礁生态系统的“源-汇”属性不一定与造礁珊瑚的碳源或碳汇功能完全一致。①从造礁珊瑚自身来看,大气CO2浓度升高可能会有效解除共生虫黄藻的碳限制,增强其光合作用和初级生产能力;但伴随CO2升高引起的海洋酸化又会抑制造礁珊瑚的钙化作用,导致其碳汇属性被削弱。模型预测,当排除珊瑚以外其他生物因素的影响时,印度洋—太平洋多个珊瑚礁生态系统在长时间季节尺度上表现出“源”或“汇”的不确定性[29]。②生态系统绝不是孤立的,珊瑚礁与其他蓝碳生态系统间存在碳的交换,而这一点常常在“源-汇”计算中被忽略。在红树林—海草床—珊瑚礁的连续生态系统中,珊瑚共生虫黄藻可固定大量来自红树林和海草床的溶解无机碳,而珊瑚自身释放到海水中的CO2也会被大型海藻、海草、钙化藻等初级生产者再次利用,因此连续生态系统在整体上表现出较强的碳汇性质[30]。除虫黄藻外,珊瑚还与细菌、古菌、真菌、病毒等其他微生物共生。中国科学家提出的“微型生物碳泵”(MCP)概念已证实微生物群落可以通过一系列代谢过程将有机碳转化为惰性溶解有机碳(RDOC)从而进行千年尺度的储存,这一储碳机制因此成为海洋蓝碳的重要“推手” [31]。虽然目前缺乏共生微生物对珊瑚礁碳循环贡献的估算依据,但这个由MCP驱动、可以在珊瑚共生体内外同时进行的RDOC储碳过程,对珊瑚礁生态系统的碳汇效应不容小觑(图 1)。
当前,人们对珊瑚礁生态系统碳“源-汇”的研究仍较为局限,特别是在细胞、水螅体和群落等不同尺度上[17]的碳循环过程及调控机制可能比之前预计的要复杂得多,其作为蓝碳储库的作用尚未明确。要从根本上解决这一问题,迫切需要在全球范围内开展有关珊瑚礁区对CO2海—气交换贡献的研究。
3 珊瑚礁生态健康及其“源-汇”效应作为一种典型的混合营养生物,造礁珊瑚在自养和异养这两种生活方式间的弹性转换会影响甚至决定珊瑚礁生态系统的碳“源-汇”属性[32]。理论上,当共生体自养生长占优势时,虫黄藻光合固定的CO2量大于珊瑚呼吸释放的CO2量,珊瑚礁区通常表现出碳汇效应;而当共生体异养生长占优势时,珊瑚会通过水螅体触手捕食浮游动物、悬浮颗粒有机物等获取额外能量,呼吸释放的CO2量超过虫黄藻光合固定的CO2量,珊瑚礁区整体往往表现为碳源效应。在外界胁迫加剧时,珊瑚会将体内共生虫黄藻大量排出(即“白化”),造成主要由虫黄藻产生、用于维持珊瑚基础代谢的自养能量无法补给、供能失衡,共生体被动经历从自养到异养的“源汇逆转”。虽然一定程度的异养捕食会缓解珊瑚的压力,但当珊瑚过度依赖异养方式而摒弃高效的、自给自足的共生体内碳循环时,珊瑚礁生态系统就极有可能发生崩塌与瓦解。由于受到环境胁迫,以及过度的人为活动(如填海、疏浚、陆源输送等)引起的营养盐、悬浮物和沉积物的长期胁迫,我国珊瑚礁正经历严重退化[33],造礁珊瑚种类更多以环境耐受型为主[34]。增强异养代谢可能是耐受型珊瑚对环境胁迫的一种应急适应方式[35],其生态效应则会从健康珊瑚礁主导的碳“汇”系统转向由退化珊瑚礁主导的碳“源”系统。
珊瑚礁成礁过程中伴随大量碳酸盐沉积,据估计珊瑚礁区CaCO3的年累积量可达0.084 Pg C(1 Pg = 1015 g),约占全球CaCO3年累积量的23%—26%[24]。可以想象,随着海水CO2浓度上升(海洋酸化),CO32–浓度、碳酸盐饱和度、珊瑚钙化率都随之下降;同时,珊瑚骨骼变脆、易碎,生长率下降,其抗风浪能力被削弱。而海洋酸化的直接后果则是CaCO3骨骼溶解向海洋释放大量CO2,对碳酸盐体系造成不可逆转的影响。此外,珊瑚礁生态系统的退化可能产生强级联效应,导致其空间结构多样性衰退、生物多样性水平下降、食物网结构简化、营养级下降等;进而发生“相变”,释放原本固定在各营养层级生物体内的有机碳,削弱珊瑚礁生态系统的储碳总量。由此可见,珊瑚礁生态系统健康时,可以是大气CO2的净汇;但当其退化时,则变成大气CO2的净源。
目前,科学技术的迅速发展为研究珊瑚礁生态健康及其碳“源-汇”效应提供了便捷。例如,基于特定化合物(如氨基酸、脂质)的δ13C稳定同位素技术可以通过示踪食物网中有机碳的迁移和分配,定量解析不同营养层级获取能量的份额大小,这有望在根本上解决珊瑚礁生态系统的碳流分配与能量溯源难题,厘清珊瑚的弹性营养方式,特别是不同健康状态下珊瑚礁的能量传递与碳流分配规律[36]。此外,近年来兴起的纳米二次离子质谱技术(NanoSIMS),可以在亚细胞超微尺度上对珊瑚共生体内有机碳转运的碳指纹进行原位示踪和定量,更加精细地描绘珊瑚—虫黄藻—微生物间营养互作、元素循环及能量传递的过程与规律,特别是珊瑚钙化、虫黄藻固碳、微生物代谢等生物过程对碳“源-汇”的贡献[37]。这些技术的应用有助于全方位、多层次揭示珊瑚礁生态系统固碳、储碳机制及碳通量的变化特征,为珊瑚礁增汇模式及途径的构建提供理论支撑。
4 珊瑚礁生态系统增汇模式及途径要从根本上解决好珊瑚礁碳“源-汇”这一问题,增加珊瑚礁的碳汇功能,可从以下4个方面入手。
(1)系统开展碳通量与碳收支研究,回答学术界长期悬而未决的珊瑚礁“源-汇”悖论。在生态系统大尺度上,研究珊瑚礁与其毗邻的蓝碳生态系统(如海草床)间能量传递的作用机制,构建针对特定海区的能量传递模型,并从提高能量传递效率的角度,探索增加蓝碳生态系统整体储碳效益的可行性[30]。同时,选择典型珊瑚礁区,开展区域尺度碳循环与碳通量比较分析,查明影响珊瑚礁碳“源-汇”问题的潜在因素、时空差异及其对气候变化与人类活动的响应。在亚细胞超微尺度上,结合高精度、高分辨率同位素示踪技术(如氨基酸δ13C示踪),原位示踪共生体内的有机碳转运过程,在此基础上构建虫黄藻、珊瑚虫、微生物间的能量传递模型[38]。
(2)加强珊瑚礁生态保护与修复,实现珊瑚礁生态健康增汇。提高珊瑚存活率和珊瑚礁覆盖率是增强珊瑚礁生态系统碳汇能力的前提。在气候变化的大背景下,珊瑚苗圃培育、珊瑚整体或断枝移植,以及人工礁等传统的、基于无性繁殖技术的修复方式[39],已难以满足提高珊瑚遗传多样性和生态系统稳定性的需求[40, 41]。而依赖珊瑚有性繁殖方式发展起来的跨纬度移植[42]、配子杂交[43]、筛选抗逆性状基因进行可遗传繁育[44]和“益生菌疗法” [45]等现代修复技术,为筛选和培育能适应环境变化的强抗逆性和高恢复力的“超级珊瑚”提供了新的思路。一方面,这些经过基因改良的“超级珊瑚”对气候变化具有弹性适应,有利于保持珊瑚礁区生物热点的多样性和稳定性,将更多的生物质有机碳储存在系统内部。另一方面,珊瑚宿主与虫黄藻间可维持长期、稳定的共生关系,提高共生藻的光合固碳能力,促进珊瑚钙化和生长,增强珊瑚礁生态系统的碳埋藏。
(3)减少陆源营养盐输入和人为活动对珊瑚礁的破坏,实现陆海统筹增汇。加强陆海统筹、减少陆源营养盐输入,可缓解近海富营养化,减少对有机碳的呼吸消耗,提高惰性碳转化效率,有效促进MCP固碳、储碳及向深海输送碳能力[46, 47]。对珊瑚礁区而言,通过妥善处理生活污水与养殖废水、加强人流密集区域的营养盐预警与监控等措施,可减少营养盐输入,保持珊瑚礁生态系统内部的营养平衡和健康状态,维持较高水平的自养生活方式[48]。而避免人类活动的强烈干扰(尤其是过度的海岸带开发、围填海、工程疏浚等活动),能够降低珊瑚礁区悬浮颗粒物浓度和浊度,从而增加光照强度,在降低珊瑚水螅体异养捕食的同时提高虫黄藻光合效率。因此,陆海统筹不仅可调控珊瑚的弹性营养方式,同时也能有效增强珊瑚礁区的潜在碳汇能力(图 1)。
(4)利用人工上升流促进营养盐循环,实现珊瑚礁生态系统内部调节增汇。人工上升流技术是一项新兴的海洋生态工程技术,已被纳入联合国政府间气候变化专门委员会(IPCC)《气候变化中的海洋与冰冻圈特别报告》(SROCCC)。该技术在滨海湿地、红树林及渔业养殖等增汇应用过程中表现突出[49]。上升流生态工程可将深海低温高营养盐海水转移至浅海珊瑚礁区,调和珊瑚礁区水质,提高虫黄藻的光合作用能力,从而改善珊瑚礁健康状况、增强其碳汇能力[50]。上升流还可以促进水流输送有机物到外海,提高由MCP过程产生的RDOC,同时减轻由人类活动和陆源输入导致的沿海潟湖富营养化的危害(图 1)。连续观测数据亦表明,相比无上升流的珊瑚礁区,珊瑚在有上升流的珊瑚礁区发生白化的概率更低且恢复能力更强,这一事实展现出人工上升流在保护生态系统甚至增汇方面潜在的应用前景[51]。
5 结语目前,气候变化无疑是全球珊瑚礁面临的最大威胁。应对气候变化的关键是碳中和,只有在尽可能减排的同时设法增汇,才能彻底解决这个问题。因此,采取合理有效的方式,保护珊瑚礁免受气候变化及人类活动带来的胁迫,增加其作为碳汇的功能,将有助于未来的珊瑚礁保护与修复工作。文章提出基于生态系统增汇的珊瑚礁修复技术路线图,倡导通过加强陆海统筹,减少陆源污染、合理规划海岸带建设等举措,在增汇的同时提高珊瑚礁对气候变化的弹性适应。这些方案目前还仅仅是粗线条框架,未来仍需要不断细化和完善,通过链接科学与政策,推动其在有条件的海区进行示范研发,以更好地服务国家“碳中和”战略的实施。
致谢 本文写作过程中牛高峰(山东大学海洋研究院)协助作图、刘依娜(自然资源部第三海洋研究所)协助收集材料,在此特致谢。| [1] |
Morais R A, Connolly S R, Bellwood D R. Human exploitation shapes productivity-biomass relationships on coral reefs. Global Change Biology, 2020, 26(3): 1295-1305. DOI:10.1111/gcb.14941 |
| [2] |
焦念志. 研发海洋"负排放"技术支撑国家"碳中和需求. 中国科学院院刊, 2021, 36(2): 179-187. |
| [3] |
Kinsey D W, Hopley D. The significance of coral reefs as global carbon sinks-Response to Greenhouse. Global and Planetary Change, 1991, 3(4): 363-377. DOI:10.1016/0921-8181(91)90117-F |
| [4] |
Hatcher B G. Coral reef primary productivity: A beggar's banquet. Trends in Ecology&Evolution, 1988, 3(5): 106-111. |
| [5] |
Kayanne H, Suzuki A, Saito H. Diurnal changes in the partial pressure of carbon dioxide in coral reef water. Science, 1995, 269: 214-216. DOI:10.1126/science.269.5221.214 |
| [6] |
Chisholm J R M, Barnes D J. Anomalies in coral reef community metabolism and their potential importance in the reef CO2 source-sink debate. PNAS, 1998, 95(11): 6566-6569. DOI:10.1073/pnas.95.11.6566 |
| [7] |
Ware J R, Smith S V, Reaka-Kudla M L. Coral reefs: Sources or sinks of atmospheric CO2?. Coral Reefs, 1992, 11(3): 127-130. DOI:10.1007/BF00255465 |
| [8] |
Macreadie P I, Anton A, Raven J A, et al. The future of Blue Carbon science. Nature Communications, 2019, 10(1): 1-13. DOI:10.1038/s41467-018-07882-8 |
| [9] |
Shi T, Niu G F, Kvitt H, et al. Untangling ITS2 genotypes of algal symbionts in zooxanthellate corals. Molecular Ecology Resources, 2021, 21(1): 137-152. DOI:10.1111/1755-0998.13250 |
| [10] |
LaJeunesse T C, Parkinson J E, Gabrielson P W, et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology, 2018, 28(16): 2570-2580. DOI:10.1016/j.cub.2018.07.008 |
| [11] |
Muscatine L. The role of symbiotic algae in carbon and energy flux in reef corals//Dubinsky Z, ed. Ecosystems of the World vol. 25: Coral Reefs. New York: Elsevier, 1990: 75-87.
|
| [12] |
Putnam H M, Barott K L, Ainsworth T D, et al. The vulnerability and resilience of reef-building corals. Current Biology, 2017, 27(11): 528-540. DOI:10.1016/j.cub.2017.04.047 |
| [13] |
Hughes T P, Kerry J T, Álvarez-Noriega M, et al. Global warming and recurrent mass bleaching of corals. Nature, 2017, 543: 373-377. DOI:10.1038/nature21707 |
| [14] |
Licuanan W Y, Robles R, Reyes M. Status and recent trends in coral reefs of the Philippines. Marine Pollution Bulletin, 2019, 142: 544-550. DOI:10.1016/j.marpolbul.2019.04.013 |
| [15] |
Huang J Z, Wang F X, Zhao H W, et al. Reef benthic composition and coral communities at the Wuzhizhou Island in the South China Sea: The impacts of anthropogenic disturbance. Estuarine, Coastal and Shelf Science, 2020, 243: 106863. DOI:10.1016/j.ecss.2020.106863 |
| [16] |
Fagan K E, MacKenzie F T. Air-sea CO2 exchange in a subtropical estuarine-coral reef system, Kaneohe Bay, Oahu, Hawaii. Marine Chemistry, 2007, 106(1-2): 174-191. DOI:10.1016/j.marchem.2007.01.016 |
| [17] |
Gattuso J P, Allemand D, Frankignoulle M. Photosynthesis and calcification at cellular, organismal and community levels in coral reefs: A review on interactions and control by carbonate chemistry. Integrative and Comparative Biology, 1999, 39(1): 160-183. |
| [18] |
Lønborg C, Calleja M L, Fabricius K E, et al. The Great Barrier Reef: A source of CO2 to the atmosphere. Marine Chemistry, 2019, 210: 24-33. DOI:10.1016/j.marchem.2019.02.003 |
| [19] |
Cotovicz L C Jr, Chielle R, Marins R V. Air-sea CO2 flux in an equatorial continental shelf dominated by coral reefs (Southwestern Atlantic Ocean). Continental Shelf Research, 2020, 204: 104175. DOI:10.1016/j.csr.2020.104175 |
| [20] |
Yan H Q, Yu K F, Shi Q, et al. Air-sea CO2 fluxes and spatial distribution of seawater pCO2 in Yongle Atoll, northern-central South China Sea. Continental Shelf Research, 2018, 165: 71-77. DOI:10.1016/j.csr.2018.06.008 |
| [21] |
de Goeij J M, van Duyl F C. Coral cavities are sinks of dissolved organic carbon (DOC). Limnology and Oceanography, 2007, 52(6): 2608-2617. DOI:10.4319/lo.2007.52.6.2608 |
| [22] |
Wimart-Rousseau C, Lajaunie-Salla K, Marrec P, et al. Temporal variability of the carbonate system and air-sea CO2 exchanges in a Mediterranean human-impacted coastal site. Estuarine, Coastal and Shelf Science, 2020, 236: 106641. DOI:10.1016/j.ecss.2020.106641 |
| [23] |
Crossland C J, Hatcher B G, Smith S V. Role of coral reefs in global ocean production. Coral Reefs, 1991, 10(2): 55-64. DOI:10.1007/BF00571824 |
| [24] |
严宏强, 余克服, 谭烨辉. 珊瑚礁区碳循环研究进展. 生态学报, 2009, 29(11): 6207-6215. DOI:10.3321/j.issn:1000-0933.2009.11.056 |
| [25] |
Furla P, Galgani I, Durand I, et al. Sources and mechanisms of inorganic carbon transport for coral calcification and photosynthesis. The Journal of Experimental Biology, 2000, 203(22): 3445-3457. |
| [26] |
Rinkevich B, Loya Y. Does light enhance calcification in hermatypic corals?. Marine Biology, 1984, 80(1): 1-6. DOI:10.1007/BF00393120 |
| [27] |
Rädecker N, Pogoreutz C, Wild C, et al. Stimulated respiration and net photosynthesis in Cassiopeia sp. during glucose enrichment suggests in hospite CO2 limitation of algal endosymbionts. Frontiers in Marine Science, 2017, 4: 267. DOI:10.3389/fmars.2017.00267 |
| [28] |
Suzuki A, Kawahata H. Carbon budget of coral reef systems: An overview of observations in fringing reefs, barrier reefs and atolls in the Indo-Pacific regions. Tellus B: Chemical and Physical Meteorology, 2003, 55(2): 428-444. DOI:10.3402/tellusb.v55i2.16761 |
| [29] |
Mayer B, Rixen T, Pohlmann T. The spatial and temporal variability of air-sea CO2 fluxes and the effect of net coral reef calcification in the Indonesian Seas: A numerical sensitivity study. Frontiers in Marine Science, 2018, 5: 116. DOI:10.3389/fmars.2018.00116 |
| [30] |
Akhand A, Watanabe K, Chanda A, et al. Lateral carbon fluxes and CO2 evasion from a subtropical mangrove-seagrass-coral continuum. Science of the Total Environment, 2021, 752: 142190. DOI:10.1016/j.scitotenv.2020.142190 |
| [31] |
Jiao N Z, Herndl G J, Hansell D A, et al. Microbial production of recalcitrant dissolved organic matter: Long-term carbon storage in the global ocean. Nature Reviews Microbiology, 2010, 8(8): 593-599. DOI:10.1038/nrmicro2386 |
| [32] |
Conti-Jerpe I E, Thompson P D, Wong C W M, et al. Trophic strategy and bleaching resistance in reef-building corals. Science Advances, 2020, 6(15): eaaz5443. DOI:10.1126/sciadv.aaz5443 |
| [33] |
Hughes T P, Huang H, Young M A L. The wicked problem of China's disappearing coral reefs. Conservation Biology, 2013, 27(2): 261-269. DOI:10.1111/j.1523-1739.2012.01957.x |
| [34] |
Darling E S, Alvarez-Filip L, Oliver T A, et al. Evaluating lifehistory strategies of reef corals from species traits. Ecology Letters, 2012, 15(12): 1378-1386. DOI:10.1111/j.1461-0248.2012.01861.x |
| [35] |
Burmester E M, Breef-Pilz A, Lawrence N F, et al. The impact of autotrophic versus heterotrophic nutritional pathways on colony health and wound recovery in corals. Ecology and Evolution, 2018, 8(22): 10805-10816. DOI:10.1002/ece3.4531 |
| [36] |
Ferrier-Pagès C, Leal M C. Stable isotopes as tracers of trophic interactions in marine mutualistic symbioses. Ecology and Evolution, 2019, 9(1): 723-740. DOI:10.1002/ece3.4712 |
| [37] |
Loussert-Fonta C, Toullec G, Paraecattil A A, et al. Correlation of fluorescence microscopy, electron microscopy, and NanoSIMS stable isotope imaging on a single tissue section. Communications Biology, 2020, 3: 362. DOI:10.1038/s42003-020-1095-x |
| [38] |
Tanaka Y, Suzuki A, Sakai K. The stoichiometry of coraldinoflagellate symbiosis: Carbon and nitrogen cycles are balanced in the recycling and double translocation system. The ISME Journal, 2018, 12(3): 860-868. DOI:10.1038/s41396-017-0019-3 |
| [39] |
Zheng X Q, Li Y C, Liang J L, et al. Performance of ecological restoration in an impaired coral reef in the Wuzhizhou Island, Sanya, China. Journal of Oceanology and Limnology, 2021, 39(1): 135-147. DOI:10.1007/s00343-020-9253-z |
| [40] |
van Oppen M J H, Gates R D, Blackall L L, et al. Shifting paradigms in restoration of the world's coral reefs. Global Change Biology, 2017, 23(9): 3437-3448. DOI:10.1111/gcb.13647 |
| [41] |
Omori M. Coral restoration research and technical developments: What we have learned so far. Marine Biology Research, 2019, 15(7): 377-409. DOI:10.1080/17451000.2019.1662050 |
| [42] |
Thomas C D. Translocation of species, climate change, and the end of trying to recreate past ecological communities. Trends in Ecology&Evolution, 2011, 26(5): 216-221. |
| [43] |
Suzuki G, Okada W, Yasutake Y, et al. Enhancing coral larval supply and seedling production using a special bundle collection system "coral larval cradle" for large-scale coral restoration. Restoration Ecology, 2020, 28(5): 1172-1182. DOI:10.1111/rec.13178 |
| [44] |
Barshis D J, Ladner J T, Oliver T A, et al. Genomic basis for coral resilience to climate change. PNAS, 2013, 110(4): 1387-1392. DOI:10.1073/pnas.1210224110 |
| [45] |
Peixoto R S, Rosado P M, Leite D C D, et al. Beneficial microorganisms for corals (BMC): Proposed mechanisms for coral health and resilience. Frontiers in Microbiology, 2017, 8: 341. |
| [46] |
Jiao N, Robinson C, Azam F, et al. Mechanisms of microbial carbon sequestration in the ocean-future research directions. Biogeosciences, 2014, 11(19): 5285-5306. DOI:10.5194/bg-11-5285-2014 |
| [47] |
Zhao H, Yuan M, Strokal M, et al. Impacts of nitrogen pollution on corals in the context of global climate change and potential strategies to conserve coral reefs. Science of the Total Environment, 2021, 774: 145017. DOI:10.1016/j.scitotenv.2021.145017 |
| [48] |
Morris L A, Voolstra C R, Quigley K M, et al. Nutrient availability and metabolism affect the stability of coralSymbiodiniaceae symbioses. Trends in Microbiology, 2019, 27(8): 678-689. DOI:10.1016/j.tim.2019.03.004 |
| [49] |
Liu C C K, Jin Q. Artificial upwelling in regular and random waves. Ocean Engineering, 1995, 22(4): 337-350. DOI:10.1016/0029-8018(94)00019-4 |
| [50] |
Radice V Z, Hoegh-Guldberg O, Fry B, et al. Upwelling as the major source of nitrogen for shallow and deep reef-building corals across an oceanic atoll system. Functional Ecology, 2019, 33(6): 1120-1134. DOI:10.1111/1365-2435.13314 |
| [51] |
Bayraktarov E, Pizarro V, Eidens C, et al. Bleaching susceptibility and recovery of Colombian Caribbean corals in response to water current exposure and seasonal upwelling. PLoS One, 2013, 8(11): e80536. DOI:10.1371/journal.pone.0080536 |




