2. 南方海洋科学与工程广东省实验室(广州)深圳分部 深圳 518055;
3. 山东大学 海洋研究院 青岛 266237;
4. 南方海洋科学与工程广东省实验室(珠海) 珠海 519000;
5. 南方科技大学 深圳海洋地球古菌组学重点实验室 深圳 518055;
6. 上海佘山地球物理国家野外科学观测研究站 上海 201602
2. Shenzhen Branch, Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Shenzhen 518055, China;
3. Institute of Marine Science and Technology, Shandong University, Qingdao 266237, China;
4. Southern Marine Science and Engineering Guangdong Laboratory (Zhuhai), Zhuhai 519000, China;
5. Shenzhen Key Laboratory of Marine Archaea Geo-Omics, Southern University of Science and Technology, Shenzhen 518055, China;
6. Shanghai Sheshan National Geophysical Observatory, Shanghai 201602, China
全球气候变化的加剧引发了全人类的持续关注。1990—2017年,全球碳排放总量由34.97 Gt增加至49.36 Gt。随着国民经济高速发展,中国同期碳排放量由2.97 Gt迅速增加至12.95 Gt,随之而来的国际舆论压力亦越来越大。中国政府在多个国际论坛和峰会上承诺“努力争取2060年前实现碳中和”的目标并宣布提高国家自主贡献力度的一系列举措,彰显负责任大国担当。目前,我国拟实现碳排放量目标值为9.54— 11.37 Gt(有条件承诺),预计到2030年达到9.28— 12.96 Gt的排放峰值(无条件承诺)。
碳中和是应对气候变化的全人类目标。这一宏伟目标可以通过2种方式实现:①减少人类排放到大气中的二氧化碳(CO2);②人为增加“碳汇”或“负排放”,即从大气中去除CO2。目前,国际社会关注的焦点是减少碳排放的途径和方法。例如,采取调整产业结构、加快能源结构演替、发展低碳技术、开发新能源等应对策略从根源上减少碳排放强度。但是,随着经济的快速发展,以及受我国能源结构现状的限制,仅靠减排不足以实现碳中和的战略目标[1, 2],我们迫切需要通过增加负排放来实现碳中和。
负排放是指通过物理、化学或生物手段捕获大气中的CO2,将其永久或在较长时间尺度内封存在地质环境中。目前,常用的负排放技术有陆地碳汇、海洋碳汇,以及碳捕获、利用和储存技术等。许多文献提出采用陆地碳汇功能来实现负排放,如:植树造林、生物栖息地恢复、土壤碳封存、生物碳生产、增强陆地风化和矿物碳化、直接空气捕获CO2并储存,以及低碳混凝土的开发和使用等[3]。但由于陆地使用面积受限,陆地碳汇功能仍有待进一步开发。
滨海湿地(如红树林、盐沼、海草床)是碳汇的重要组成部分。尽管它们仅占海洋表面的0.2%,但由于土壤巨大的固碳潜力、高固碳效率和长期(数千年)碳储存能力,它们贡献了50% 的碳埋藏,具有减少温室气体排放和增加碳汇的潜力[4, 5]。然而,由于我国滨海湿地受围垦、港口开发、陆源污染等人为活动干扰,面临湿地面积骤减、湿地生态系统退化等问题[6]。据2019年度最新监测结果显示,中国滨海湿地面积由1975年的736万公顷降低至524.5万公顷,减少了约28.7%[7],并由此导致海洋碳汇功能锐减。
据估计,自18世纪以来,海洋吸收的CO2已占化石燃料排放量的41.3% 左右和人为排放量的27.9% 左右,极大抵消了大气中CO2的积累[8]。因此,采用新的方法和技术增加海洋碳汇强度,发挥海洋负排放潜力,理应是应对碳中和目标的重要路径之一。
2 核心主题地球上55% 的生物碳或绿色碳捕获是由海洋生物完成的。海洋作为CO2的缓冲系统,其容量巨大——整个海洋中蓄积的碳总量达到3.9×1013 t,占全球碳总量的93%,约为大气的53倍[9]。因此,作为地球上最大的活跃碳库,海洋在气候变化中扮演着举足轻重的作用[10, 11]。海洋储碳一个重要的过程是生物泵(BP),它是指由光合藻类生物、浮游动物等作用,将大气CO2转变成颗粒有机碳(POC)并被沉降到海底的过程。地球上的50% 的光合作用是由海洋藻类完成的,海藻能够有效地利用太阳能,通过光合作用固定CO2,将无机碳溶解转化为有机碳。但是,由生物泵导致的POC向深海的输出效率并不高,能够到达海底埋葬的有机碳量大约只有海洋初级生产力的0.1%,绝大部分POC在沉降途中被降解呼吸转化成CO2,大幅降低了BP储碳的效率[12, 13]。
微型生物碳泵(MCP)理论指出海洋微型生物是惰性有机碳(RDOC)的主要贡献者[14, 15],其表现在3个方面:①微型生物细胞在生长代谢过程中改造并分泌RDOC;②病毒颗粒裂解导致宿主细胞的死亡和裂解并释放RDOC;③原生动物等捕食者摄食微型生物细胞并释放RDOC[13]。MCP理论为海洋碳循环中的碳封存提供了行之有效的指导[12, 16],在海洋碳循环和全球气候变化研究领域产生了重大国际影响[14, 16]。
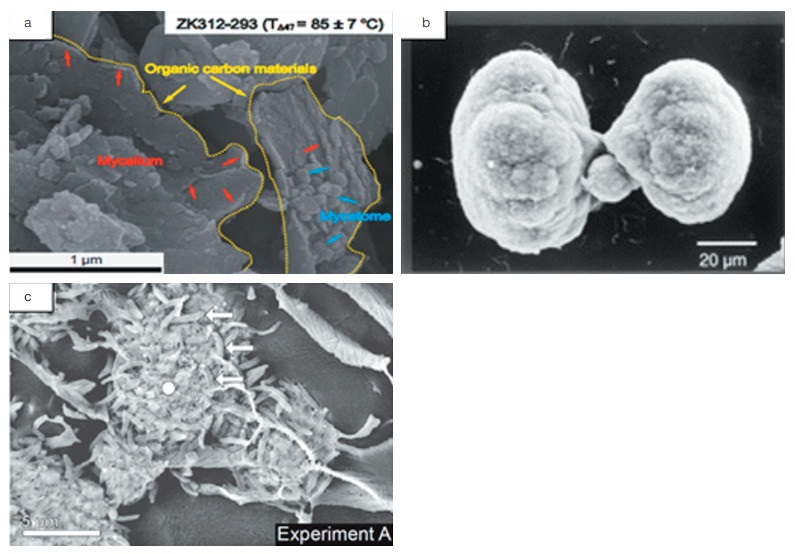
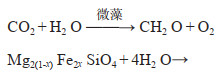
碳酸盐碳泵(CCP)是微生物诱导产生碳酸盐沉淀的过程(图 2),是自然界中广泛存在的一种生物诱导矿化作用[17-21]。例如,海底叠层岩就是以蓝菌(蓝藻)为主的微生物在生长和新陈代谢活动过程中粘附和沉淀矿物质或捕获矿物的颗粒而形成的一种生物沉积构造[22]。海洋微生物诱导产生碳酸盐沉淀的另外一个典型代表就是冷泉碳酸盐的形成。冷泉碳酸盐岩是甲烷等碳烃化合物由深部向上渗漏过程中,在海底厌氧条件下经甲烷氧化古菌和硫酸盐还原细菌共同代谢,产生的碱度优势促使HCO3−和Ca2+过饱和结晶而形成的一种矿物[23, 24]。此外,地质历史记录和实验模拟(图 1和2)都表明微生物(特别是硫酸根还原菌)在白云石(钙、镁的碳酸盐)的形成过程中占主导作用[25, 26]。CCP所产生的矿物质可以在海底沉积物中保存上亿年(图 1),因此能够在地质历史时间尺度发挥调节气候变化的作用。
|
| 图 1 地质历史纪录和实验室模拟形成的微生物成因的碳酸钙矿物 Figure 1 Biogenic calcium carbonate minerals formed by geological history records and laboratory simulation (a)前寒武纪(~5亿年前)陡山沱组保存完好的微生物白云岩化石,显示有保存完好的有机质、丰富的菌丝和菌体[27];(b)实验室硫酸盐还原菌诱导作用下生成的哑铃状白云石球体,聚合形成花椰菜状构造[26];(c)可见死亡的细菌细胞(箭头所示的椭圆形拉长的特征)与碳酸盐球结合在一起[28] (a) Microbial dolomite fossils from the Precambrian (~ 500 million years ago), Doushantuo Formation is well preserved, in which organic matter, abundant hyphae, and bacteria are shown[27]; (b) Under simulated conditions in laboratory, dumbbell shape dolomite was induced by sulfate reducing bacteria, and polymerized to form cauliflower structure[26]; (c) Dead bacterial cells can be seen[28] |
BP、MCP和CCP是海洋储碳的重要机制。光合藻类生物将大气CO2转化为有机物、微生物主导的MCP产生溶解惰性有机质(主要在水体中)及形成固体矿物质(主要在沉积物中)是长期的自然过程。本文旨在探讨利用生态工程,研究如何将光合藻类产生的有机质由BP快速传输到海底沉积物;然后,在沉积物的厌氧条件下,利用MCP和CCP的协同作用,产生大量惰性有机质和固体碳酸盐矿物,达到大气CO2被长期甚至永久封存的目的。这一“三泵集成”设想,仅靠自然过程难以实现。而生态工程的愿景将是通过促进光合藻类生长、施加橄榄石粉和黏土矿物等类似物质使得藻类有机质快速沉积,并在海底形成厌氧环境(黏土矿物作用),由微生物将易降解有机质在高pH值和高碱度(橄榄石水解作用)条件下转变成HCO3−与Ca2+结合,大幅提升碳酸钙矿物的产生速率。
3 预期成效 3.1 “三泵集成”的机制目前,对海洋环境中微生物诱导碳酸盐沉淀的研究主要集中于矿物的形成机制和元素的循环过程,而未见对生物泵-微型生物碳泵-碳酸盐碳泵(BP-MCPCCP)在海洋环境中的协同储碳的机理和过程的集成研究。开展BP-MCP-CCP协同储碳机制的研究,将会对实现海洋CO2负排放、调节全球气候环境起到至关重要的理论指导,并提供场景范例。
具体来讲就是以海洋微藻为大气CO2主要捕获载体,首先在表层海水中扩大培养海洋微藻,将大气中CO2捕获至海水中(式1)[29, 30]。MCP-CCP协同储碳过程的第二步为通过在海藻生长海域抛洒橄榄石、黏土矿物等,将生成的微藻生物体在矿物的吸附作用和重力作用下快速沉积到海底。此过程的5个主要目的为:①添加的橄榄石水解会提升其周围水环境的碱度(式2)[32];②黏土矿物附着海藻与橄榄石一起沉积到海底,在海底形成厌氧环境,促进海底硫酸盐还原菌在厌氧环境下还原SO42−(式3)[33, 34];③使海藻快速沉积到海底,防止海藻在水体大量分解造成厌氧环境而对海水生物体的生存造成影响;④铁橄榄石水解生成还原性铁(式2)与反应(式3)生成的H2S反应形成黄铁矿(FeS2)(式4)[35, 36],使得H2S不以气体形式溢出沉积物;⑤ HCO3−与海洋中存在的Ca2+反应在碱性环境下生成CaCO3(式5);产生的CO2在高碱度和高pH的缓冲系统中变成HCO3−而不被逸出(式6)。
 (1)
(1)
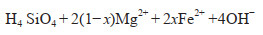 (2)
(2)
 (3)
(3)
 (4)
(4)
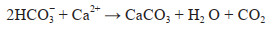 (5)
(5)
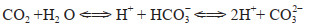 (6)
(6)
对于上述BP-MCP-CCP协同储碳的设想,目前的主要研究重点和难点有4个方面。
(1)人类智能化BP。探究藻类达到可沉降所需丰度(藻华、赤潮)的生长速率和时间,研究橄榄石粉和黏土矿物沉降藻类的最佳颗粒及最优混合比例;考虑不同微藻的生态特性和储碳效率,从海水环境中天然存在的生态友好的微藻种类入手,初步圈定潜在可能用于MCP-CCP储碳工程的微藻种类。
(2)MCP功能延伸。研究底栖MCP的过程与机制,评判海底沉积物的非均质性对MCP过程和机制的影响;解析微生物(细菌、古菌)和病毒在不同氧化还原条件下对颗粒有机质降解的动力学过程,以及沉积物环境中矿物与有机质互作关系对RDOC产生和降解的影响。厘清底栖MCP特征与广海水体MCP特征的区别:①微型生物细胞在生长代谢过程中改造并分泌RDOC;②病毒颗粒裂解导致宿主细胞的死亡和裂解并释放RDOC;③原生动物等捕食者摄食微型生物细胞并释放RDOC。
(3)微生物矿物工程。研究形成碳酸盐矿物(如方解石、文石、白云石)的微生物群落结构特征和成岩效率;搭建CO2浓度和光照可控条件下MCP-CCP储碳的室内实验模型,设定实验参数,研究CO2浓度、光照对储碳效率的影响,研究橄榄石、黏土矿物的颗粒尺寸、混合比例及加入量对储碳效率的影响;寻求最优储碳效率下的实验参数;从模型实验层面探讨反应机理。结合研究结果,总结规律,引入比例系数,探讨并预测BP-MCP-CCP储碳在实际大规模的海水环境中的时空演化规律,从而对该项技术实现海洋负碳排放的长期作用效果进行评估。
(4)生态环境影响评估及保护。 “三泵集成”海洋负碳排放生态工程的实施过程中,一方面需解决橄榄石及黏土矿物负载微藻在重力作用下快速沉降至海底;另一方面,先期开展生态系统水平模拟实验,研究并评估这一步骤对生态系统可能带来的影响,并提出科学应对措施,以期为后续模型预测提供准确的过程参数。同时,此过程中的黏土自上而下沉降过程中有可能吸附海水中的污染性杂质(如微塑料等),可对海水起到一定程度的净化作用。黏土矿物等沉降至海床表面,覆盖住藻类,快速形成沉积厌氧环境,从而保证CCP的过程的发生,进而形成碳酸盐矿物。由于黏土矿物及产生的碳酸钙均为天然矿物,成分与常见的海床沉积物如淤泥质黏土及碳酸盐砂质海床沉积物成分类似,因此对海床的成分与环境不会造成负面影响。值得注意的是,即使科学原理是清晰的,依然需要在充分生态综合效应评估的基础上逐步实施。
4 科学和生态工程研究意义展望(1)BP-MCP-CCP协同储碳的研究对于认识全球气候变化的海洋调控机制具有重要意义。由于微生物群落和溶解有机碳(DOC)元素组成、化学结构的多重复杂性,因而BP-MCP-CCP的详细过程仍需要进一步被解析。一方面,海洋升温将加剧海洋层化、减弱水柱混合,从而减少来自深水向真光层的营养盐补充,使得表层水更加贫瘠。在这种情况下,初级生产过程及其碳分流比例将发生变化:DOC比例上升,而POC比例下降。全球变暖将削弱基于POC沉降的经典BP,而增强基于DOC的MCP的作用。另一方面,CCP亦可将MCP分流部分的有机碳永久封存至海底,提高MCP-CCP协同储碳效率。
(2)BP-MCP-CCP的研究需尽快系统的开展。目前,在海洋储碳方面,国际上还没有统一的规范和标准,我国应该把握此战略时机,尽快开展海洋储碳方面的系统研究。通过室内培养实验、船载模拟现场培养实验、海洋现场围隔实验,获取第一手数据资料和生态过程参数[15]。在此基础上建立有关数学模型,模拟不同环境条件和生态情景下MCP与CCP的调控机制和变动规律,进而建立海洋储碳研究的整套观测技术和分析方法,以及海洋储碳的评价标准体系。上述研究将填补国际空白,发挥先导与引领作用,服务于我国实现碳中和国家战略,同时带来巨大的生态环境效益、社会经济效益和国际政治效应。
(3)BP-MCP-CCP协同储碳有望加速海洋负排放的实施进程,满足国家碳负排放的重大战略需求。中国是世界上受气候变化影响的脆弱地区之一。未来气候变化将对中国区域旱涝灾害、水资源、生物多样性、生态系统、农林牧渔业和人体健康等产生重要影响,并将对中国的社会经济发展带来一系列挑战。BPMCP-CCP协同储碳正是着眼于海洋碳循环和全球气候变化的大背景,将研究深入到海洋微型生物及微生物成矿作用,从新的角度探索海洋碳循环的机制,并在此基础上提出海洋储碳有效途径;同时,对于缓解我国CO2减排的压力,保障经济平稳较快发展,提高我国在气候问题国际谈判方面的话语权、主动权及国际政治地位都具有战略意义。
| [1] |
IPCC. Intergovernmental Panel on Climate Change. Global Warming of 1.5℃. Cambridge: Cambridge University Press, 2018.
|
| [2] |
Tortell P. Earth 2020:An Insider's Guide to a Rapidly Changing Planet. Cambridge: Open Book Publishers, 2020.
|
| [3] |
Royal Society and Royal Academy of Engineering, Greenhouse Gas Removal. London: Royal Society, 2018.
|
| [4] |
Duarte C M, Losada I J, Hendriks I E, et al. The role of coastal plant communities for climate change mitigation and adaptation. Nature Climate Change, 2013, 3(11): 961-968. DOI:10.1038/nclimate1970 |
| [5] |
Taillardat P, Friess D A, Lupascu M. Mangrove blue carbon strategies for climate change mitigation are most effective at the national scale. Biology Letters, 2018, 14(10): 20180251. DOI:10.1098/rsbl.2018.0251 |
| [6] |
Ilyina T, Wolf-Gladrow D, Munhoven G, et al. Assessing the potential of calcium-based artificial ocean alkalinization to mitigate rising atmospheric CO2 and ocean acidification. Geophysical Research Letters, 2013, 40(22): 5909-5914. DOI:10.1002/2013GL057981 |
| [7] |
张健, 李佳芮, 杨璐, 等. 中国滨海湿地现状和问题及管理对策建议. 环境与可持续发展, 2019, 44(5): 127-129. |
| [8] |
秦大河, 周波涛. 气候变化与环境保护. 科学与社会, 2014, 4(2): 19-26. DOI:10.3969/j.issn.2095-1949.2014.02.003 |
| [9] |
刘慧, 唐启升. 国际海洋生物碳汇研究进展. 中国水产科学, 2011, 18(3): 695-702. |
| [10] |
Lal R. Carbon sequestration. Philosophical Transactions of the Royal Society B: Biological Sciences, 2008, 363: 815-830. DOI:10.1098/rstb.2007.2185 |
| [11] |
Azam F, Smith D C, Steward G F, et al. Bacteria-organic matter coupling and its significance for oceanic carbon cycling. Microbial Ecology, 1994, 28(2): 167-179. DOI:10.1007/BF00166806 |
| [12] |
焦念志, 张传伦, 李超, 等. 海洋微型生物碳泵储碳机制及气候效应. 中国科学: 地球科学, 2013, 43(1): 1-18. |
| [13] |
张传伦, 孙军, 刘纪化, 等. 海洋微型生物碳泵理论的发展与展望. 中国科学: 地球科学, 2019, 49(12): 1933-1944. |
| [14] |
Jiao N Z, Herndl G J, Hansell D A, et al. Microbial production of recalcitrant dissolved organic matter: Long-term carbon storage in the global ocean. Nature Reviews Microbiology, 2010, 8(8): 593-599. DOI:10.1038/nrmicro2386 |
| [15] |
焦念志. 海洋固碳与储碳——并论微型生物在其中的重要作用. 中国科学: 地球科学, 2012, 42(10): 1473-1486. |
| [16] |
Zhang C L, Dang H Y, Azam F, et al. Evolving paradigms in biological carbon cycling in the ocean. National Science Review, 2018, 5(4): 481-499. DOI:10.1093/nsr/nwy074 |
| [17] |
Seifan M, Berenjian A. Microbially induced calcium carbonate precipitation: A widespread phenomenon in the biological world. Applied Microbiology and Biotechnology, 2019, 103(12): 4693-4708. DOI:10.1007/s00253-019-09861-5 |
| [18] |
Zhu T T, Dittrich M. Carbonate precipitation through microbial activities in natural environment, and their potential in biotechnology: A review. Frontiers in Bioengineering and Biotechnology, 2016, 4: 1-21. |
| [19] |
Wang Y Z, Soga K, DeJong J T, et al. Microscale visualization of microbial-induced calcium carbonate precipitation processes. ASCE Journal of Geotechnical and Geoenvironmental Engineering, 2019, 145(9): 04019045. DOI:10.1061/(ASCE)GT.1943-5606.0002079 |
| [20] |
Whiffin V S. Microbial CaCO3 Precipitation for the Production of Biocement. Peth: Murdoch University, 2004.
|
| [21] |
Wang Y Z. Microbial-Induced Calcium Carbonate Precipitation: from Micro to Macro Scale. Cambridge: University of Cambridge, 2018.
|
| [22] |
Grotzinger J P, Rothman D H. An abiotic model for stromatolite morphogenesis. Nature, 1996, 383: 423-425. DOI:10.1038/383423a0 |
| [23] |
Hinrichs K U, Hayes J M, Sylva S P, et al. Methane-consuming archaebacteria in marine sediments. Nature, 1999, 398: 802-805. DOI:10.1038/19751 |
| [24] |
Boetius A, Ravenschlag K, Schubert C J, et al. A marine microbial consortium apparently mediating anaerobic oxidation of methane. Nature, 2000, 407: 623-626. DOI:10.1038/35036572 |
| [25] |
Vasconcelos C, McKenzie J A, Bernasconi S, et al. Microbial mediation as a possible mechanism for natural dolomite formation at low temperatures. Nature, 1995, 377: 220-222. DOI:10.1038/377220a0 |
| [26] |
Warthmann R, van Lith Y, Vasconcelos C, et al. Bacterially induced dolomite precipitation in anoxic culture experiments. Geology, 2000, 28(12): 1091-1094. DOI:10.1130/0091-7613(2000)28<1091:BIDPIA>2.0.CO;2 |
| [27] |
Chang B, Li C, Liu D, et al. Massive formation of early diagenetic dolomite in the Ediacaran ocean: Constraints on the dolomite problem". PNAS, 2020, 117(25): 14005-14014. DOI:10.1073/pnas.1916673117 |
| [28] |
Bontognali T R R, McKenzie J A, Warthmann R J, et al. Microbially influenced formation of Mg-calcite and Ca-dolomite in the presence of exopolymeric substances produced by sulphate-reducing bacteria. Terra Nova, 2014, 26(1): 72-77. DOI:10.1111/ter.12072 |
| [29] |
Ho S H, Chen C Y, Lee D J, et al. Perspectives on microalgal CO2-emission mitigation systems-A review. Biotechnology Advances, 2011, 29(2): 189-198. DOI:10.1016/j.biotechadv.2010.11.001 |
| [30] |
Farrelly D J, Everard C D, Fagan C C, et al. Carbon sequestration and the role of biological carbon mitigation: A review. Renewable and Sustainable Energy Reviews, 2013, 21: 712-727. DOI:10.1016/j.rser.2012.12.038 |
| [31] |
Riveros G A, Sadrekarimi A. Liquefaction resistance of Fraser River sand improved by a microbially-induced cementation. Soil Dynamics and Earthquake Engineering, 2020, 131: 106034. DOI:10.1016/j.soildyn.2020.106034 |
| [32] |
Montserrat F, Renforth P, Hartmann J, et al. Olivine dissolution in seawater: Implications for CO2 sequestration through enhanced weathering in coastal environments. Environmental Science&Technology, 2017, 51(7): 3960-3972. |
| [33] |
Mondal S, Ghosh A. Review on microbial induced calcite precipitation mechanisms leading to bacterial selection for microbial concrete. Construction and Building Materials, 2019, 225: 67-75. DOI:10.1016/j.conbuildmat.2019.07.122 |
| [34] |
Rajasekar A, Moy C K S, Wilkinson S. MICP and advances towards eco-friendly and economical applications. IOP Conference Series: Earth and Environmental Science, 2017, 78(1): 012016. |
| [35] |
Rickard D, Luther G W III. Kinetics of pyrite formation by the H2S oxidation of iron (II) monosulfide in aqueous solutions between 25 and 125 C: The Rate Equation. Geochimica et Cosmochimica Acta, 1997, 61(1): 115-147. DOI:10.1016/S0016-7037(96)00321-3 |
| [36] |
Olson S L, Ostrander C M, Gregory D D, et al. Volcanically modulated pyrite burial and ocean-atmosphere oxidation. Earth and Planetary Science Letters, 2019, 506: 417-427. DOI:10.1016/j.epsl.2018.11.015 |





