2. 中国科学院 科技促进发展局 北京 100864;
3. 首都医科大学附属北京胸科医院 北京 101100;
4. 中国疾病预防控制中心 北京 102206
2. Bureau of Science & Technology for Development, Chinese Academy of Sciences, Beijing 100864, China;
3. Beijing Chest Hospital, Capital Medical University, Beijing 101100, China;
4. Chinese Center for Disease Control and Prevention, Beijing 102206, China
结核病(Tuberculosis,TB)这一由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染引起的古老的慢性传染病至今依然严重危害人类健康,尤其影响到最贫穷和脆弱的群体。在过去的2000年中,TB已造成超过10亿人死亡,全球每年依然有约150万人死于TB。世界卫生组织(WHO)提出了《终止结核病战略》(2016—2035年)的目标,联合国也提出了《变革我们的世界:2030年可持续发展议程》的TB控制目标和2035年终止TB流行的目标,这些目标设定的年限距今分别只剩下不到14年和9年的时间[1-3]。但是,按目前趋势计算,依靠现有技术手段,人类消灭TB的目标可能要在160年后的2182年才可能实现[4]。
在与传染病进行较量时,人类最有力的武器就是科学技术。因此,最终战胜TB这一难治性慢性传染病也离不开科学发展和技术创新。WHO的《 2020年全球结核病报告》中列出的优先事项包括:降低感染风险的疫苗、降低约20亿已感染人群罹患TB风险的疫苗或新药等[5]。时不我待,如果不采取紧急行动加强科技攻关,全球TB防治目标很可能无法实现。本文总结了全球及我国TB发展态势,分析了科技在TB防治中的贡献,并针对科学防控TB进行了思考并提出了一系列建议,包括加强TB的基础研究研发、研发新型TB疫苗和药物、发展新型TB诊断技术手段、健全体系支撑并加强保障措施等。本文旨在推进我国防治TB的科技布局及政策制定与落实,最终促进《终止结核病战略》目标的实现。
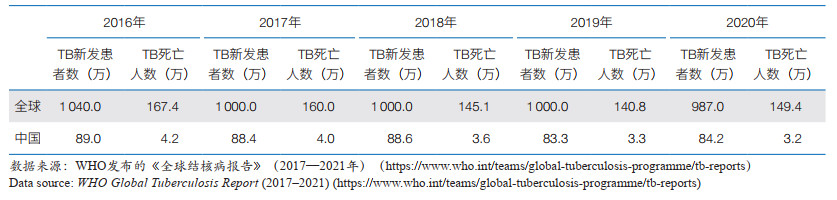
1 TB发展态势 1.1 全球和我国TB流行现状根据WHO最近发布的《 2021年全球结核病报告》,2020年全球TB新发患者数为987万,估算发病率持续呈现下降趋势[6]。但受新冠肺炎疫情影响,大量TB患者未被及时确诊并及时治疗,导致TB死亡数从2019年的140.8万增加到2020年149.4万,这是近15年来的首次上升(表 1)。同时,耐药TB仍然是一项严峻的全球公共卫生危机[6]。2019年,全球有近50万名利福平耐药TB(RR-TB)患者,其中78% 为耐多药TB(MDR-TB)。此外,研究显示:全球敏感TB治疗成功率为85%,而MDR/RR-TB治疗成功率仅为57%。还需要指出的是,新冠肺炎大流行的蔓延造成TB患者医疗的可及性显著降低,减少了TB患者就诊;据模型估算,全球TB防控因新冠肺炎疫情倒退5—8年[5]。
我国多年来一直是TB大国,是全球30个TB高负担、30个耐药TB高负担和30个TB/艾滋病(HIV)合并感染高负担国家之一。2020年,我国估算的TB新发患者数为84.2万,从2019年的全球第3位上升至第2位,仅次于印度[6](表 1)。我国的耐药TB负担尤为严峻,每年估算RR-TB新发患者数6.5万,位居全球第二位。此外,我国约有超过70% 的耐药TB患者尚未被发现,这将造成人际传播的巨大风险,并成为我国控制TB的严峻挑战[5]。另外,我国现存巨大的潜伏感染人群,总计有超过3.65亿人感染过Mtb,高居全球第二位[7];这些患者在一生中均有可能发展为活动性TB,因此对潜伏感染者的早期精准干预意义重大。
1.2 全球TB防控目标及实现情况2014年和2015年,WHO会员国和联合国分别承诺终止TB流行的战略目标和议程中包含了TB发病率、死亡率,以及TB患者及其家庭面临费用大幅下降的具体里程碑目标[1, 2]。2017年WHO召开全球TB问题部长级会议,该会议成果是《终止结核病莫斯科宣言》 [7]。2018年,联合国大会举行史上首次TB问题高级别会议,有国家元首、政府首脑等各方领导人参会。会议制定了政治宣言,重申了对《变革我们的世界:2030可持续发展议程》和《终止结核病战略》的承诺并增加了新承诺。会上还首次为TB预防、治疗与科研资金的需求,以及TB感染和患者治疗人数设定了全球目标[3]。
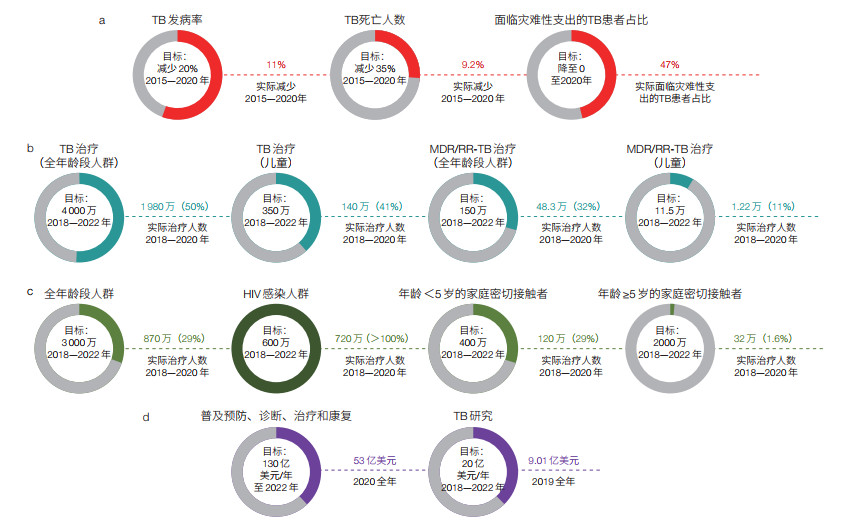
WHO和联合国提出的“终止全球结核病流行”的具体目标是:与2015年相比较,2030年TB死亡率下降90%,发病率下降80%;2035年,分别下降95% 和90%[1-3]。尽管有上述一系列政治宣言和宏伟目标,但从目前的进展来看,这些全球TB防控目标进度迟缓。近5年,全球每年新发TB患者人数基本维持在同一个水平。根据WHO最新发布的《 2021年全球结核病报告》,大多数WHO成员国和TB高负担国家未能实现《终止结核病战略》 2020年的里程碑目标。此外,新冠肺炎大流行对TB防控工作造成了巨大的负面影响(图 1)[6]。
|
| 图 1 世界卫生组织(WHO)的《终止结核病战略》和联合国终止结核病流行政治宣言的目标实现情况[6] Figure 1 Current situation and milestone progress towards targets set by WHO End TB Strategy and UN's political declaration on fight against TB[6] (a)WHO的《终止结核病战略》设定的2020年里程碑目标及实现情况;(b)联合国TB高级别会议:患者治疗目标及实现情况;(c)联合国TB高级别会议:TB预防性治疗目标及实现情况;(d)联合国TB高级别会议:经费目标及实现情况 (a) WHO End TB Strategy: 2020 milestones; (b) UN high-level meeting on TB: Treatment targets; (c) UN high-level meeting on TB: TB preventive treatment targets; (d) UN high-level meeting on TB: Funding targets |
TB患者给家庭带来严重的经济负担。据一项全国调查显示:每名TB患者平均自付经济负担超过1.5万元,约有1/4的TB患者因病致贫,因而TB防治成为健康中国的重要挑战[8]。党中央、国务院高度重视TB防治工作,并将TB防治战略写入了2016年中共中央、国务院印发的《“健康中国2030”规划纲要》,这也是我国履行对联合国《变革我们的世界:2030可持续发展议程》承诺的重要举措[9]。近年来,我国还出台了一系列TB防控政策和保障措施,有效地促进了我国TB疫情的持续下降(2020年度受新冠肺炎疫情影响稍有回升除外)[6, 10](表 1)。除了管理方面的举措,TB防治目标的最终实现依赖于科技攻关能力的全面提升。根据《国家中长期科学和技术发展规划纲要(2006—2020年)》,经国务院批准,由国家卫生健康委员会和中央军委后勤保障部卫生局牵头组织实施的国家科技重大专项“艾滋病和病毒性肝炎等重大传染病防治”于2008年启动。该专项在“十一五”“十二五”和“十三五”实施期间取得了诸多进展,主要包括:①在TB诊断方面。研发出了多项TB细菌学、免疫学和分子生物学诊断新技术,使Mtb检测时间由4—8周缩短至6小时以内,痰液中Mtb的检出率由25% 提高到50%①;此外,在潜伏感染者的筛查方面,开发的重组Mtb融合蛋白用于潜伏感染人群的筛查,提高了目标人群的发现水平[11]。②在TB治疗方面。针对TB发病人数多、耐药严重的问题,以诊断和可持续治疗为重点,成功研发系列诊断产品并优化治疗方案,使MDR-TB病死率降低9%,达到国际先进水平②。③在TB疫苗研究方面。目前,在全球注册的14个TB疫苗研究中,我国自主研发的AEC/BC02和Vaccae 2种疫苗位列其中[5]。
① 中华人民共和国科学技术部.“艾滋病和病毒性肝炎等重大传染病防治”国家科技重大专项新闻发布会. (2018-03-27)[2021-11]. http://www.most.gov.cn/xwzx/twzb/fbh18032701/index.html.
② 中华人民共和国科学技术部. 艾滋病和病毒性肝炎等重大传染病防治科技重大专项交流材料. (2016-01-11). http://www.most.gov.cn/ztzl/qgkjgzhy/2016/2016jlcl/2016jlzdzx/201601/t20160111_123544.html.
尽管取得了上述多项成果,但是距离2035年终止TB的目标,我国的TB防治工作依然任重而道远,并面临一系列重大挑战,主要包括:缺乏TB的有效预防手段。用于预防TB的疫苗目前只有卡介苗(BCG)1种,且其对于成人肺结核的保护效力有限,新型TB疫苗研发尚需找到新的突破口;我国拥有庞大的TB潜伏感染人群,急需适宜的免疫干预手段;尚缺乏有效鉴定TB易感人群的筛查方式,这些感染人群中病原清除的免疫学机制也尚不明晰,无法有效开展早期筛查并采取有效的保护措施;耐药TB患者的治疗目前依赖于抗TB药物,但是现有药物对耐药TB患者的治疗成功率仅为50%[12],亟待探索基于新机制和新策略的新型TB治疗性疫苗等更有效的TB治疗手段。
2.2 TB领域的科研进展及其在TB防治中的应用前景基础和应用基础研究的深入探索,以及创新技术的发展应用,可为科技防治TB提供坚实的理论基础和有力的技术支撑。以下简要介绍TB领域的研究进展,主要包括TB基础研究进展和防治新靶点发现、TB新疫苗开发、抗TB新药研发,以及TB临床治疗新方案研究等。
2.2.1 TB基础研究进展和防治新靶点发现对于Mtb感染、发病和宿主免疫防御机制的认识,以及新靶点和新标志物的发现,是开发TB防治新手段的关键。以下从3个方面介绍一些近年在TB基础研究领域的进展。
(1)耐药TB的流行病学及其基因组特征。系统地分析Mtb临床耐药菌株的流行病学及耐药基因组特征有助于了解Mtb耐药的发展趋势并提供新的耐药分子标识物和新药靶。①耐药TB的流行病学分析。 Zhao等[13]通过对中国的耐药TB情况进行调查发现:我国的耐药TB疫情严重,新发、复发TB病例中MDR-TB的比例分别为5.7%、25.6%,并且约8% 的MDR-TB病例同时也是广泛耐药TB(XDR-TB)病例。② TB耐药基因组的特征。毕利军团队通过对161株从临床分离的耐药Mtb进行全基因组和转录组测序及数据分析,系统发现了72个新的耐药相关基因和28个非编码区,为建立新型TB耐药检测方法和药物研发提供了一批新的耐药标识物及药物靶标[14]。
(2)TB免疫应答机制。 Mtb和宿主免疫系统之间的互作和博弈决定了其感染结局。相关方面的进展主要包括:①在Mtb的宿主免疫逃逸机制方面。刘翠华团队近年与高福和邱小波团队合作发现Mtb效应蛋白PtpA利用宿主泛素抑制固有免疫进而促进病原胞内存活的新机制[15];揭示Mtb表面蛋白Rv1468c招募宿主泛素触发宿主异体自噬进而调控宿主炎症免疫反应强度的新机制[16];发现Mtb效应蛋白PknG发挥非经典泛素化酶活性抑制固有免疫的新机制,以及通过其不同结构域及其激酶活性阻断自噬流并促进病原胞内存活的新机制等[17, 18]。戈宝学团队和饶子和团队合作揭示了一种新型的依赖宿主E3连接酶ANAPC2导致Mtb Rv0222泛素化来破坏宿主免疫应答的新机制[19]。②在宿主的抗Mtb感染免疫机制方面。 Khan等[20]揭示Mtb感染能够激活Ⅰ型干扰素/铁代谢信号轴,抑制骨髓生成并损害保护性“训练免疫”,与卡介苗引发的保护性训练免疫背道而驰,提示了骨髓来源巨噬细胞中一种新的病原菌免疫逃逸策略;Ji等[21]解析了Ⅰ型干扰素与TB易感性的相关性,并证明IL-1α是体内Ⅰ型干扰素驱动的TB易感性的重要调节因子;Scheuermann等[22]解析了肺组织中血小板在TB发病进程中的动力学改变和相互作用分子,提示可望通过调节固有免疫应答来重塑肺部免疫应答。
(3)TB药物靶标的作用机制及结构解析。最近,国内外在TB药物靶标的作用机制及结构解析研究方面也取得重要进展,主要包括:张颖团队首次发现了TB一线药物吡嗪酰胺的首个作用靶标RpsA,并揭示了吡嗪酰胺通过RpsA抑制Mtb的蛋白质翻译过程杀灭Mtb的分子机制,为进一步筛选TB候选药物提供了重要参考[23]。饶子和团队解析了乙胺丁醇靶标EmbA-EmbB、EmbC-EmbC二聚体复合物结构,证实了乙胺丁醇的药物作用靶点和分子机制,为乙胺丁醇的优化和靶向Emb蛋白的新药研发提供了理论依据[24]。Rempel等[25]合作证实Rv1819c是维生素B12(钴胺素)的转运蛋白,并且Rv1819c可能成为开发TB药物的理想新靶标;他们还解析了Mtb Rv1819c的三维晶体结构。Guo等[26]揭示了贝达喹啉抑制三磷酸腺苷(ATP)酶活性的三维构象,为TB药物结构修饰提供了参考。
2.2.2 TB新疫苗开发目前,唯一获得许可的TB疫苗BCG不足以遏制全球TB流行:BCG虽然可为婴幼儿提供中等至良好的保护,可以预防重症TB,但它不能保护青少年和成年人这些TB传播的主体人群。因此,急需研发更有效的TB新疫苗。目前,至少有14种候选疫苗正在积极临床开发中[5]。其中,Tait等[27]报道的新型佐剂蛋白疫苗M72/AS01E的Ⅱ b期临床试验结果显示其对潜伏感染TB者的保护率约50%——该疫苗已获准在部分低收入国家使用。另外,还有数种TB疫苗处于临床前阶段。其中有的研究尝试通过改变疫苗接种方式提升其免疫保护力。例如,有研究发现通过静脉注射方式接种BCG,9/10感染Mtb的猕猴未发展为活动TB,6/10的猕猴未检测到TB感染[28]。另一研究表明:用腺病毒的疫苗在黑猩猩中单剂量黏膜免疫可增进TB控制并抑制抗生素停用后的复发[29]。这一系列研究为TB疫苗增效提供了新思路。然而,已有的候选疫苗几乎都没有表现出抗原和免疫多样性。因此,急需开发以多种方式发挥作用的新疫苗,尤其是防止建立初始感染(暴露前)或防止发展成疾病(暴露后)的新型TB疫苗。
2.2.3 TB新药研发全球范围内,TB新药研发一度滞缓。近几年随着全球对传染性疾病的逐渐重视,国内、外均增加了在研或进入临床试验阶段的TB新药。目前,对敏感TB的治愈率约为85%,而对耐药TB的治愈率仅为34%—55%,加之耐药TB患者的治疗需要至少9— 20个月的二线药物疗程。因此,针对耐药TB患者的新药研发一直是全球关注的重点。目前,一些地区已批准3种新药(贝达喹啉、德拉马尼和普瑞玛尼)用于治疗耐药TB,但这些新药存在有效性不足且毒性较大等局限性,仅能作为联合治疗方案的一部分。还有数种TB药物处于临床前和临床试验阶段。例如,Ouchi等[30]研发的WQ-3810是一种新型抗耐药结核的氟喹诺酮类药物,可通过作用于Mtb的DNA螺旋酶发挥作用。Telacebec(Q203)则是de Jager等[31]研发的另一种新型TB药物,其可通过抑制细胞色素bc1复合物来影响病原菌能量代谢;针对该药的Ⅱ期临床试验初步结果显示其具有良好的体外和体内抗Mtb活性。尽管已看到了可喜的进展,但是TB药物的耐药性发生是必然的,仍需要研发更多高效、低毒的抗结核新药以应对不断产生的耐药TB。
2.2.4 TB临床治疗新方案研究在TB新药研发跟不上临床需求的现阶段,针对TB的临床治疗方案进行优化是有效提升TB防治能力的重要措施之一。该方面主要进展包括:Abidi等[32]系统比较了标准化短疗程方案(9—12个月)和传统长疗程方案(18—20个月或更长)效果,发现短疗程组的治疗成功率(80.0%)高于长疗程组(75.3%)。Conradie等[33]报道了在南非开展的适用于广泛耐药/耐多药TB(XDR/MDR-TB)患者的全口服化疗方案,其中使用了包含3种口服药品(贝达喹啉、利奈唑胺和普瑞玛尼)的耐药TB治疗方案;结果显示,该方案治疗完成率更高,且治疗效果并不劣于传统方案,治疗成功率为90%。Franke等[34]报道了一项包含1 109例耐药TB患者的多个国家参与的使用贝达喹啉和(或)德拉马尼的临床队列短期研究;结果显示,85% 的研究对象在治疗6个月内痰菌转阴,HIV感染者的阴转率为73%,低于未感染HIV者的84%。
综上,TB研究领域已日益受到重视并取得了可喜的新进展。我们也欣喜地看到,我国TB研究领域近年也涌现出一系列具重大影响力的原创性和引领性的研究成果。但同时,也应认识到,我国在TB领域的科技支撑尚不充分、源头科技供给还远不足。因此,尚需加强我国TB领域的总体布局和系统研究,从而更好地助力TB科技防治工作的进步。
3 科技防治TB的思考和建议尽管全球、各区域和各国在消除TB方面取得了进展,但要实现全球TB防控目标,迫切需要进一步加强高效务实的科技防治TB的行动。我国作为TB大国,TB防治工作仍然面临诸多挑战,主要体现在基于新机制、新理论、新策略的源头科技创新供给依然严重不足。为深入贯彻“面向人民生命健康”国家战略导向,力争“十四五”时期在TB科技防治领域实现突破并有力支撑科技强国建设,急需尽早做好顶层设计,系统科技布局,加大攻关力度,研发具有自主知识产权的TB防治新技术、新方法、新手段。基于此,本文针对我国科技防治TB提出5个方面的建议。
3.1 加强TB的基础研究TB的发病机制异常复杂且与宿主的免疫、代谢等多方面密切相关,而目前对于TB的发病机制尚缺乏全面、深入的了解。需进一步加强Mtb与宿主互作的动态调控机制、TB的保护性免疫机制等方面的研究,为TB新疫苗和新药研发提供新策略和新靶点。此外,TB与肺结节病、炎症性肠病等自身免疫性疾病、糖尿病等代谢性疾病及肿瘤等疾病密切相关,并且存在这些基础疾病的人群往往也是TB的易感人群。因此,TB及其共患病可能存在共性的宿主免疫学发病机制,加强TB与这些共患病的共性发病机制研究将可能揭示TB易感的分子标识,从而为潜伏感染高危人群的筛查提供新标识,同时还可能为TB共患病提供共性防治新手段。
3.2 开发新型TB疫苗TB疫苗除了可预防TB感染以外,还可望作为免疫治疗剂,以缩短TB治疗时间或降低治疗结束后的复发风险,从而减少耐药TB的发展和扩散。此外,有效的TB疫苗还可以应对耐药TB并通过预防疾病而减少对抗生素的需求,从而有利于避免耐药性的发生。《终止结核病全球战略》呼吁每年提供大约2.5亿美元推进TB新疫苗研发。但2005—2017年,平均每年投资仅为9 500万美元[5]。面对居高不下的TB疫情和严重的Mtb耐药情况,急需进一步阐明Mtb感染过程中肺部区域黏膜免疫的应答特征尤其是TB的保护性免疫机制,并基于新理论、新策略和新靶点开发更高效和安全的新型TB疫苗;同时,探索新的疫苗免疫学评价手段,并开发疫苗增效新策略用以提高疫苗的保护效力和持久性。
3.3 研发TB新药耐药TB患者的治疗依赖于TB药物,但是现有药物对耐药TB患者的治疗成功率较低,并且现有TB药物易引发Mtb发生耐药。我国的原创性TB药物开发能力较为缺乏,科技成果转化率低;今后需加强基于新机制的源头创新的TB新药研发,并且在TB新药研发中需考虑到对耐药TB的有效性、尽量减少耐药的发生。宿主导向的免疫治疗药物是未来研究的主要方向之一,其理念是:消除病原导致的免疫逃逸和免疫耗竭,提升宿主的保护性免疫反应,同时减少过度炎症反应及免疫病理反应导致的组织损伤。宿主导向的免疫治疗药物有望作为耐药TB的重要治疗手段之一,与传统的抗生素类TB药物联用还可能缩短疗程并缓解耐药发生。因此,加强Mtb感染状态下的宿主免疫机制研究并开发基于宿主的TB免疫治疗药物将具有重要的临床应用价值。此外,基于TB的复杂发病机制和慢性感染的特点,可探索中药复方及其成分在TB防治中的作用及机制,并深入研究中西医结合治疗TB的新方案。
3.4 发展新型TB诊断技术手段TB的早期及时确诊对于尽早治疗患者、减少疾病传播至关重要。TB尤其是耐药TB和潜伏感染者的诊断方法和技术尚待提升,急需发现新型诊断标志物,包括可区分活动性TB和潜伏感染者的血液标志物、耐药基因分子诊断靶标等。在诊断技术方面,需进一步开发具有更高敏感度和特异性的即时便携式检测方法和手段。此外,由于尚缺乏有效鉴定TB易感人群的筛查方式,既往的筛查方式大多基于某个基因位点突变与TB发病的关联,且其免疫学机制不明,无法有效开展早期筛查并采取有效的保护措施。同时,由于TB易感及发病机制复杂并且影响因素众多,需从系统、整体和动态的角度进行多层次生命组学(包括基因组、蛋白质组、泛素化修饰蛋白质组及代谢组)的整合分析与比较,系统发现可动态指示Mtb感染进展状态的宿主特征分子,筛选并精确验证可用于TB快速检测与鉴别诊断、提示潜伏感染发病和治疗预后的生物标识物。
3.5 健全体系支撑并加强保障措施科技是实现《终止结核病全球战略》的重要基础,而科技防治TB需要有力的创新环境和资源条件。
(1)营造TB科学研究和技术创新的有利环境。制定政策鼓励新的合作研究模式,加强政府和社会资本合作;支持样本、数据等资源和知识产权共享;简化和统一审查研究规程及产品监管程序,提高持续、高效地开展研究并将研究成果进行快速转化和利用的能力;采取一系列财政和非财政的激励措施刺激从基础研究、技术开发到成果转化等各个层面的创新。
(2)加大对TB领域的资金投入。 TB的基础研究,以及疫苗开发、药物研发和诊断手段提升等关键领域,长期缺乏充足的经费支持;而且,市场的吸引力也不足以激励企业对TB领域资金投入的积极性。因此,急需政府加大对TB基础研究的稳定支持,帮助解决TB诊防治新技术和新手段开发早期阶段未得到满足的资金需求,并倡议和鼓励企业等开发者联合开发。
(3)推进TB领域的创新型人才培养。 TB诊防治新技术和新手段均有赖于对TB的致病和免疫机制更深入和全面的了解。因此,需要进一步推进TB基础研究和技术创新领域的人才培养,进一步激励、支持和培养一批训练有素的创新型人员队伍,为TB的原创研究持续注入新生力量。
4 结语我国的TB防治既面临一系列重大挑战,但同时也迎来了重大机遇。展望“十四五”,我国的TB防治科技攻关前景光明。我们应当抓住机遇,迎难而上,团结协作,开拓创新,为加快推动我国TB防治进度并为全球TB防控目标实现贡献中国力量和中国智慧。
| [1] |
WHO. The End TB Strategy: Global strategy and targets for tuberculosis prevention, care and control after 2015. (2014- 05-19)[2021-11-29]. https://www.who.int/tb/strategy/End_TB_Strategy.pdf?ua=1.
|
| [2] |
UnitedNations. Transforming Our World: The 2030 Agenda for Sustainable Development. (2015-09-25)[2021- 11-29]. https://sustainabledevelopment.un.org/post2015/transformingourworld.
|
| [3] |
WHO. Preparation for a high-level meeting of the General Assembly on ending tuberculosis. (2018-05-26)[2021-11-29]. https://apps.who.int/gb/ebwha/pdf_files/WHA71/A71_R3-en.pdf.
|
| [4] |
StopTB Partnership. Change will be difficult, but no change will be fatal. (2015-10-31)[2021-11-29]. https://www.stoptb.org/news/change-will-be-difficult-no-change-will-be-fatal.
|
| [5] |
WHO. Global Tuberculosis Report 2020. (2020-10- 15)[2021-11-29]. https://www.who.int/publications/i/item/9789240013131.
|
| [6] |
WHO. Global Tuberculosis Report 2021. (2021-10-14)[2021- 11-29]. https://www.who.int/publications/i/i/9789240037021.
|
| [7] |
WHO. Moscow declaration to End TB; First WHO global ministerial conference, Ending TB in the sustainable development ERA: A multisectoral pesponse. (2017-11- 17)[2021-11-29]. https://www.who.int/tb/features_archive/Moscow_Declaration_to_End_TB_final_ENGLISH.pdf?ua=1.
|
| [8] |
Liu Y, Xu C H, Wang X M, et al. Out-of-pocket payments and economic consequences from tuberculosis care in eastern China: income inequality. Infectious Diseases of Poverty, 2020, 9(1): 14. DOI:10.1186/s40249-020-0623-8 |
| [9] |
中共中央, 国务院. "健康中国2030"规划纲要. (2016- 10-25)[2021-11-14]. http://www.cnprs.com/images/2030gy.pdf. CPC Central Committee and State Council. Outline of "healthy China 2030". (2016-10-25)[2021-11-14]. http://www.cnprs.com/images/2030gy.pdf. (in Chinese) |
| [10] |
徐彩红, 周向梅, 范伟兴, 等. 我国结核病防治主要成就回眸及亟待解决的问题与建议. 中国防痨杂志, 2020, 42(12): 1263-1267. Xu C H, Zhou X M, Fan W X, et al. Review of major achievements and problems to be solved in tuberculosis control and suggestions in China. Chinese Journal of Antituberculosis, 2020, 42(12): 1263-1267. DOI:10.3969/j.issn.1000-6621.2020.12.002 |
| [11] |
中国防痨协会, 中国防痨协会学校与儿童结核病防治专业分会, 《中国防痨杂志》编辑委员会. 重组结核杆菌融合蛋白(EC)临床应用专家共识. 中国防痨杂志, 2020, 42(8): 761-768. Chinese Antituberculosis Association, Schools and Children Branch of the Chinese Antituberculosis Association, Editorial Board of Chinese Journal of Antituberculosis. Expert consensus of clinical application of the recombinant Mycobacterium tuberculosis fusion protein (EC). Chinese Journal of Antituberculosis, 2020, 42(8): 761-768. DOI:10.3969/i.issn.1000-6621.2020.08.001 |
| [12] |
Xu C H, Pang Y, Li R Z, et al. Clinical outcome of multidrugresistant tuberculosis patients receiving standardized second line treatment regimen in China. Journal of Infection, 2018, 76(4): 348-353. DOI:10.1016/j.jinf.2017.12.017 |
| [13] |
Zhao Y L, Xu S F, Wang L X, et al. National survey of drugresistant tuberculosis in China. The New England Journal of Medicine, 2012, 366(23): 2161-2170. DOI:10.1056/NEJMoa1108789 |
| [14] |
Zhang H T, Li D F, Zhao L L, et al. Genome sequencing of 161 Mycobacterium tuberculosis isolates from China identifies genes and intergenic regions associated with drug resistance. Nature Genetics, 2013, 45(10): 1255-1260. DOI:10.1038/ng.2735 |
| [15] |
Wang J, Li B X, Ge P P, et al. Mycobacterium tuberculosis suppresses innate immunity by coopting the host ubiquitin system. Nature Immunology, 2015, 16(3): 237-245. DOI:10.1038/ni.3096 |
| [16] |
Chai Q Y, Wang X D, Qiang L H, et al. A Mycobacterium tuberculosis surface protein recruits ubiquitin to trigger host xenophagy. Nature Communications, 2019, 10(1): 1973. DOI:10.1038/s41467-019-09955-8 |
| [17] |
Wang J, Ge P P, Lei Z H, et al. Mycobacterium tuberculosis protein kinase G acts as an unusual ubiquitinating enzyme to impair host immunity. EMBO Reports, 2021, 22(6): e52175. |
| [18] |
Ge P P, Lei Z H, Yu Y, et al. M. tuberculosis PknG manipulates host autophagy flux to promote pathogen intracellular survival. Autophagy, 2021, 1-19. |
| [19] |
Wang L, Wu J H, Li J, et al. Host-mediated ubiquitination of a mycobacterial protein suppresses immunity. Nature, 2020, 577: 682-688. DOI:10.1038/s41586-019-1915-7 |
| [20] |
Khan N, Downey J, Sanz J, et al. M. tuberculosis reprograms hematopoietic stem cells to limit myelopoiesis and impair trained immunity. Cell, 2020, 183(3): 752-770. DOI:10.1016/j.cell.2020.09.062 |
| [21] |
Ji D X, Yamashiro L H, Chen K J, et al. Type Ⅰ interferondriven susceptibility to Mycobacterium tuberculosis is mediated by IL-1Ra. Nature Microbiology, 2019, 4(12): 2128-2135. DOI:10.1038/s41564-019-0578-3 |
| [22] |
Scheuermann L, Pei G, Domaszewska T, et al. Platelets restrict the oxidative burst in phagocytes and facilitate primary progressive tuberculosis. American Journal of Respiratory and Critical Care Medicine, 2020, 202(5): 730-744. DOI:10.1164/rccm.201910-2063OC |
| [23] |
Shi W L, Zhang X L, Jiang X, et al. Pyrazinamide inhibits trans-translation in Mycobacterium tuberculosis. Science, 2011, 333(6049): 1630-1632. DOI:10.1126/science.1208813 |
| [24] |
Zhang L, Zhao Y, Gao Y, et al. Structures of cell wall arabinosyltransferases with the anti-tuberculosis drug ethambutol. Science, 2020, 368: 1211-1219. DOI:10.1126/science.aba9102 |
| [25] |
Rempel S, Gati C, Nijland M, et al. A mycobacterial ABC transporter mediates the uptake of hydrophilic compounds. Nature, 2020, 580: 409-412. DOI:10.1038/s41586-020-2072-8 |
| [26] |
Guo H, Courbon G M, Bueler S A, et al. Structure of mycobacterial ATP synthase bound to the tuberculosis drug bedaquiline. Nature, 2021, 589: 143-147. DOI:10.1038/s41586-020-3004-3 |
| [27] |
Tait D R, Hatherill M, van der Meeren O, et al. Final analysis of a trial of M72/AS01 E Vaccine to prevent tuberculosis. The New England Journal of Medicine, 2019, 381(25): 2429-2439. DOI:10.1056/NEJMoa1909953 |
| [28] |
Darrah P A, Zeppa J J, Maiello P, et al. Prevention of tuberculosis in macaques after intravenous BCG immunization. Nature, 2020, 577: 95-102. DOI:10.1038/s41586-019-1817-8 |
| [29] |
Afkhami S, Lai R, D'agostino M R, et al. Single-dose mucosal immunotherapy with chimpanzee adenovirus-based vaccine accelerates tuberculosis disease control and limits its rebound after antibiotic cessation. The Journal of Infectious Diseases, 2019, 220(8): 1355-1366. DOI:10.1093/infdis/jiz306 |
| [30] |
Ouchi Y, Mukai T, Koide K, et al. WQ-3810: A new fluoroquinolone with a high potential against fluoroquinolone-resistant Mycobacterium tuberculosis. Tuberculosis, 2020, 120: 101891. DOI:10.1016/j.tube.2019.101891 |
| [31] |
de Jager V R, Dawson R, van Niekerk C, et al. Telacebec (Q203), a new antituberculosis agent. The New England Journal of Medicine, 2020, 382(13): 1280-1281. DOI:10.1056/NEJMc1913327 |
| [32] |
Abidi S, Achar J, Neino M M A, et al. Standardised shorter regimens versus individualised longer regimens for rifampin- or multidrug-resistant tuberculosis. The European Respiratory Journal, 2020, 55(3): 1901467. DOI:10.1183/13993003.01467-2019 |
| [33] |
Conradie F, Diacon A H, Ngubane N, et al. Treatment of highly drug-resistant pulmonary tuberculosis. The New England Journal of Medicine, 2020, 382(10): 893-902. DOI:10.1056/NEJMoa1901814 |
| [34] |
Franke M F, Khan P, Hewison C, et al. Culture conversion in patients treated with Bedaquiline and/or Delamanid. A prospective multicountry study. American Journal of Respiratory and Critical Care Medicine, 2021, 203(1): 111-119. DOI:10.1164/rccm.202001-0135OC |