2. 中国人民解放军 61221部队 北京 100091
2. Unit 61221 of People's Liberation Army, Beijing 100091, China
美国“脑计划”(Brain Research through AdvancingInnovative Neurotechnologies,BRAIN Initiative)是由白宫科学技术政策办公室发起的一项政府与民间联合支持的研究计划,被称为美国推进对人类大脑功能整体理解的“登月计划”[1]。美国“脑计划”通过推动创新神经技术开展大脑研究,旨在研究大脑的工作机制以彻底更新人类对大脑的理解,绘制大脑动态图谱以显示单细胞在复杂神经回路中的时空互作,以及针对无法治愈的大脑疾病开发新疗法。美国“脑计划”的独特性是以研究健康大脑的工作机制为首要科学目标,而不限于对特定疾病的重点关注,通过探索保持群体共性和个性背后的神经科学机制,最终提高人类对自身的认知。美国“脑计划”在战略规划布局、实施进度安排、主要研究方向、项目组织管理等方面做了大量周密而细致的工作,使其平稳进入茁壮成长的新阶段,具有较高的借鉴价值。文章希望通过介绍美国“脑计划”,为当前我国脑计划的新启航提供一些有益的启示和思考。
1 组织实施进展美国“脑计划”自2014年启动,经过近10年发展,由以美国国立卫生研究院(NIH)为核心构建自上而下的多层次组织管理网络,资助开展了一系列科研项目,取得了一系列瞩目成就。其在2019年后的新发展阶段布局和陆续启动的一系列大型变革性脑科学项目将产生重要数据资源,为疾病诊治提供强大的知识平台和技术支撑,最终将加速美国“脑计划”目标的实现。
1.1 发展历程2011年9月,在美国科维理基金会、艾伦脑科学研究所和盖茨基金会共同赞助的会议上,美国哥伦比亚大学神经技术中心主任拉斐尔・尤斯特提出美国“脑计划”雏形:通过开发新技术追踪大脑功能连接活动[2]。2013年4月,时任总统奥巴马宣布启动“脑计划”,以加快新技术的开发和应用,绘制出大脑中每个神经元的每个动作,并在后续经过了相关学科科学家集中征集意见和反复辩论。2014年6月,NIH“脑计划”工作组提出了“以实现科学性和伦理性愿景为目标”的“脑计划”战略报告《2025年脑科学:一个科学愿景》(BRAIN 2025: A Scientific Vision,BRAIN 2025),强调注重创新技术在神经科学、神经系统疾病研究等方面的应用。2019年10月,“脑计划”2.0(BRAIN 2.0)工作组提出了中期战略报告《美国“脑计划” 2.0:从细胞到神经回路,再到治疗》(The BRAIN Initiative® 2.0: From Cells to Circuits, Toward Cures,BRAIN 2.0),进一步明确未来脑科学研究的优先事项和投资事项(表 1)。2022年9月,美国“脑计划”启动部分BRAIN 2.0项目:细胞图谱网络(BICAN)和可用于精准访问脑细胞的设备,其目标是加强对大脑细胞类型及其访问工具的理解,以帮助进一步解码大脑复杂的工作机制。
美国“脑计划”是一项“自上而下”设计的国家型科学发展规划,分为战略规划和组织实施两个层次(图 1)。① 战略规划层面。NIH作为美国“脑计划”的依托单位,其院长弗朗西斯·柯林斯作为美国“脑计划”的领导者,主导整体战略规划和中期战略报告的制定和实施。NIH院长牵头召集领域内顶级科学家组建NIH院长咨询委员会(ACD)的“脑计划”高级别工作组2.0,内设“脑计划”神经伦理亚组,作为中坚力量和智囊团掌舵“脑计划”的战略方向与落地实施。其中“脑计划”高级别工作组2.0负责在BRAIN 2025报告框架下评估“脑计划”进展,明确用于解析脑回路工作机制的关键工具和需持续资助的有价值研究领域;“脑计划”神经伦理亚组负责评估当前研究相关的社会伦理影响,为美国“脑计划”制定神经伦理发展路线图。② 组织实施层面。NIH共有10个研究所/中心(ICs)作为“脑计划”的管理主体,各个ICs代表与联邦成员代表等组建“脑计划”多理事会工作组和神经伦理学工作组,ICs负责管理美国“脑计划”的国会拨款,多理事会工作组负责长期监督“脑计划”资助项目的实施,并确保“脑计划”的发展方向不偏离BRAIN 2025的长期愿景,负责在发布资助公告前对新项目进行“初步”概念审查,并确保“脑计划”的所有ICs咨询委员会知悉“脑计划”的项目资助及其进展情况,以便于其进行二次审查和正式批复;神经伦理学工作组负责明确研究中的伦理问题和预测伦理挑战,向研究人员提供伦理学咨询,资助神经伦理研究项目和发布伦理问题指南。
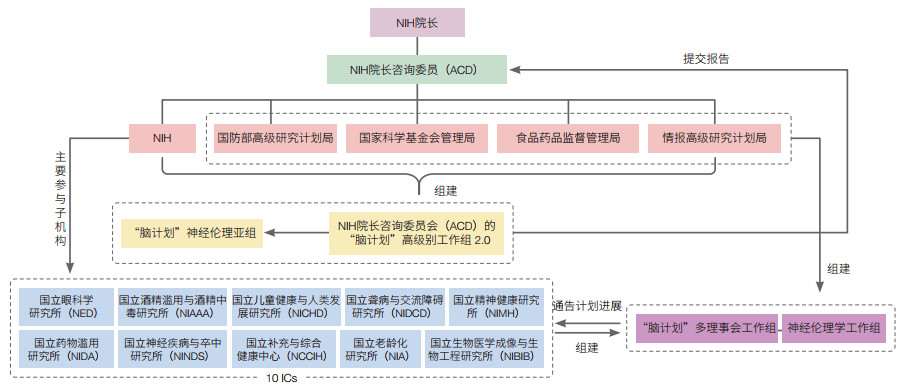
|
| 图 1 美国“脑计划”的组织架构 Figure 1 Organization structure of the US BRAIN Initiative |
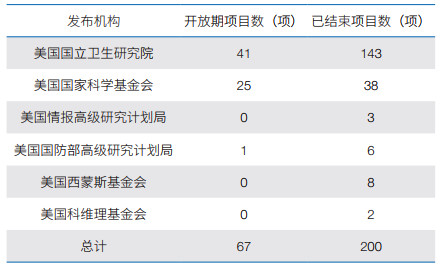
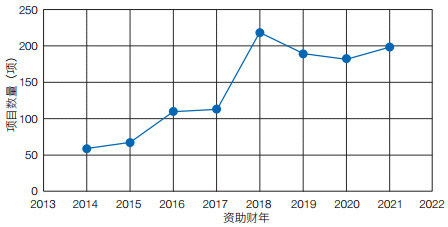
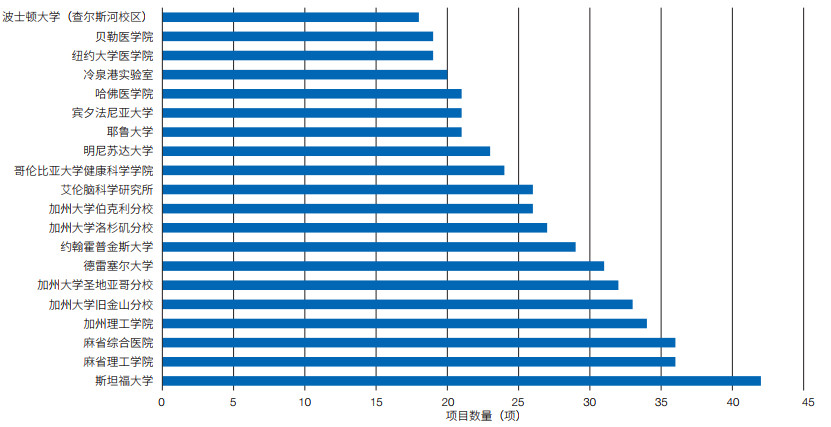
(1)已有资助项目。美国“脑计划”资助的科研项目包括资助机会(funding opportunities)类和资助奖(funded awards)类。① 资助机会类项目。以“资助机会公告”(funding opportunity announcements,FOAs)形式发布。官网数据显示,截至2022年10月,67项FOAs处于开放状态,200项FOAs已结束。NIH既是美国“脑计划”的管理机构,也是项目主要资助机构,其他资助机构包括美国国家科学基金会(NSF)、美国情报高级研究计划局(IARPA)、美国国防部高级研究计划局(DARPA)、美国西蒙斯基金会和美国科维理基金会,其中NIH资助的FOAs数量最多,其次为NSF(表 2)。② 资助奖类项目。共计1 137项,从2014年起资助项目数量逐年递增,直至2018年达峰,2019年稍有回落,从2020年起继续保持上升趋势(图 2)。前15位承研机构以高校为主,其中美国斯坦福大学(承研项目42项)高居榜首,美国麻省理工学院和麻省综合医院(承研项目均为36项)位居其次,美国艾伦脑科学研究所(承研项目26项)和冷泉港实验室(承研项目20项)亦位列其中(图 3)。
|
|
| 图 2 2014—2021财年美国“脑计划”资助的资助奖类项目数量 Figure 2 Project numbers of funded awards for Fiscal Year 2014–2021 of the US BRAIN Initiative |
|
| 图 3 美国“脑计划”资助的资助奖类项目的主要承研机构(前15位) Figure 3 Top 15 organizations responsible for funded awards of the US BRAIN Initiative |
(2)拟开展项目。根据BRAIN 2.0发展规划,下一步将推进以下5个可产生重要数据资源的大型项目:① “为认识脑功能和脑功能障碍性疾病提供细胞特异性解决方案”项目。实现可永久标记任何生物体的细胞群,通过操纵特定细胞类型可逆调控细胞功能。② “人脑细胞图集”项目。旨在生成一个大数据量和高精度的全人类大脑细胞图集。③ “小鼠大脑的连接组学”项目。全面绘制整个小鼠大脑的空间连接图,以实现脑回路从“突触”到“功能调控和行为”的跨越式研究。④ “基于神经回路的疗法”项目。通过高时空精度干预特定神经回路,实现大脑功能的长期改变,以缓解神经精神类疾病症状。⑤ “记忆和离线大脑”项目。从突触到全脑网络多个尺度,在神经活动和行为测量之间建立关联,建立大规模神经活动图谱,解析大脑从不同的记忆系统中检索和利用信息的机制。
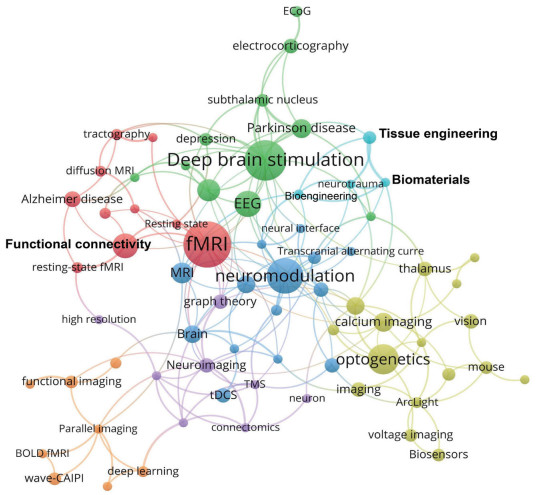
1.4 主要学术成就截至2022年10月,美国“脑计划”自启动以来共计发表学术论文1 248篇。利用Bibexcel软件进行文献计量,Pajek软件进行文献关键词聚类分析,Vosviewer软件进行可视化,得到美国“脑计划”论文关键词共现网络图谱(图 4)。结果表明,以下7类关键技术分别作为每一类的最大节点,与其他节点共现的总频次最高。
|
| 图 4 美国“脑计划”论文关键词共现网络图谱 Figure 4 The US BRAIN Initiative's publications based keyword co-appearance network |
(1)功能核磁共振(fMRI)。该聚类包括静息态功能核磁共振(resting-state fMRI)、示踪成像(tractography)、扩散核磁共振成像(diffusion MRI)、功能性连接(functional connetivity)、阿尔茨海默病(Alzheimer’s disease)和轻度认知损害(mild cognitive impairment,MCI)等节点。以分子水平功能核磁共振成像为代表的新型功能核磁技术发展迅速,例如,麻省理工学院首次对神经递质多巴胺开展分子水平功能核磁研究[4],该技术可对光学手段无法检测到的活体大脑区域进行检测,同时实现细胞尺度测量和无创性全脑成像[5]。
(2)深部脑刺激(deep brain stimulation,DBS)。该聚类包括帕金森病(Parkinson’s disease)、癫痫(epilepsy)、抑郁症(depression)和脑电图(EEG)等节点。美国“脑计划”推动了DBS技术在抑郁症个体化治疗中的应用。美国埃默里大学研究了对抑郁症的DBS个体化治疗策略,对胼胝体扣带下区行高频DBS治疗难治性抑郁症(TRD)[6];美国凯斯西储大学开发了手术室应用软件StimVision,易于图像引导病人个体化立体定位系统中进行DBS电极靶向刺激,有助于新型DBS治疗抑郁症的临床路径开展和电极靶向效果的术后评估[7]。
(3)神经调制(neuromodulation)。该聚类包括神经接口(neural interface)、经颅交流电(transcranial alternating current)、超声聚焦(focused ultrasound)、电生理学(electrophysiology)等关键节点。美国“脑计划”主要资助了新型非侵入性神经调制技术及工具的研发,包括开发和测试利用其他形式能量且具有高时空分辨率的神经调制技术,以及对现有神经调整技术的优化。美国加州理工学院通过功能性超声波(fUS)的脑成像数据追踪猴脑活动变化,结合对应任务通过深度学习算法处理,从而解码行为意图。该方法对大脑活动记录的准确率高且对脑组织友好,有助于中风、瘫痪等疾病治疗[8]。
(4)光遗传学(optogenetics)。该聚类包括嗅球(olfactory bulb)、初级视觉皮层(primary visual cortex)、丘脑(thalamus)、钙成像(calciumimaging)、双光子显微镜(two-photon microscopy)等节点。光遗传学技术是调制神经元活动的强大工具之一, 美国"脑计划"资助的新型光遗传学技术项目在对不同神经元群体"多色"光遗传控制方面取得了重大进展。劳伦斯利弗莫尔国家实验室、密歇根大学和纽约大学的研究人员通过联合开发一种结构更紧凑、可扩展和侵入性更小的柔性聚合物神经探针阵列, 突破了传统光遗传学技术仅能通过单色光控制一种神经元类型的局限, 有助于阐释神经环路的细胞机制, 为创伤后应激障碍和阿尔茨海默病提供了潜在治疗方法[9]。
(5)神经成像(neuroimaging)。该聚类包括神经元(neuron)、连接组学(connectomics)和神经网络(neural networks)等节点。神经影像学在大多数脑部疾病的治疗中发挥了重要作用,人脑微观结构成像、结构—功能成像相关技术发展迅速[10]。2020年,由IARPA资助的美国“脑计划”项目MICrONS取得了突破性进展。美国艾伦研究所开发了一种通过高通量透射电子显微镜绘制神经元环路的自动成像管道,可支持在跨脑区皮质微环路水平上获取数据,该成像技术的适用性较强,既适用于大型研究中心,也适用于小型独立实验室[11]。
(6)功能成像(functional imaging)。该聚类包括平行成像(parallel imaging)、深度学习(deep learning)、图像重建(image reconstruction)等节点。美国“脑计划”资助开发了高密度脑电图等[12]新型功能成像技术,该技术可实现动态绘制信号来源和大脑底层网络,未来可能产生动态功能成像领域的新范式。由NIH、NSF、科维理基金会和DARPA联合资助的集成神经光子学国际合作项目取得进展,该项目集成光学、电子学和光遗传学的技术进展,在脑组织快速深度功能成像方面显示了巨大应用潜力,可能实现对特定脑区重要结构的活动进行深度密集记录[13]。
(7)组织工程(tissue engineering)。该聚类包括生物材料(biomaterials)、生物工程(bioengineering)和神经创伤(neurotrauma)。活性生物电极的设计和引入大大降低了脑机接口存在的持续排异反应,改善了神经活性界面的有效性。美国宾夕法尼亚大学开发了一种由微型水凝胶柱构成的微组织工程化神经网络(micro-TENNs)[14],其独特性在于,微型水凝胶柱由一系列生物材料构成,具有可控的机械和生物学特性,可诱导神经元和轴突在细胞外基质的支持下形成轴突束排列的三维“模拟大脑神经网络”[15],可用于神经修复与再生。
2 美国“脑计划”实施特点分析美国“脑计划”自启动以来,通过紧前布局总体战略愿景框架、部署细化研究方向、注重跨部门和多地区合作、营造多学科融合和伦理道德保证的科研环境,使得项目稳步推进,在中期进行了战略适度调整,明确了新阶段的重点方向和远近目标,使其在先进技术开发和脑病治疗等领域取得了一系列引领性创新。
2.1 注重以发展先进技术为切入点美国“脑计划”提出,技术本身及其衍生出的一系列工具将有助于认识神经系统在健康和疾病中发挥的作用,这也是实现BRAIN 2025愿景的最佳方式。美国“脑计划”资助的研究论文以功能核磁、深部脑刺激、光遗传学等先进技术[16]为研究主题,将其转化为人类认识大脑和脑病治疗的有用工具,凸显了美国“脑计划”对发展先进技术的重视。该计划通过发布“优化和验证新型神经科学技术和方法(PA-18-871和PA-18-870)”的资助机会类项目等方式,积极推进创新型神经技术的开发,在优先研究领域内取得诸多技术突破。在细胞水平,通过开发基于病毒载体的CRISPRs[17, 18]和TALENs,或基于非病毒载体的抗体靶向脂质体,促进面向特异细胞的转基因技术开发,提高将外源基因序列整合至基因组的效率。在动物水平,结合现代染料示踪技术、遗传标记及整体成像技术(如美国斯坦福大学研发的突破性大脑透视技术CLARITY[19, 20]),为研究神经元之间的长距离连接和神经环路,建立完整、真实的大脑结构三维图像提供了可能性。
2.2 鼓励跨部门协同推进“脑计划”实施美国政府鼓励美国国家机构、学术研究组织、非营利性基金会及企业跨部门协同合作、共同推动,构建了多元合作组织管理模式,以顺利推进“脑计划”。西蒙斯基金会、艾伦脑科学研究所、FDA、IARPA、科维理基金会、NIH、NSF和电气与电子工程师协会脑技术社区(IEEE Brain)共同组建了“脑计划”联盟(BRAIN Initiative Alliance,BIA),有力推进了“脑计划”成员之间的跨部门协同。由基金会、大学、12家企业和2个社会团体组织构成的非联邦机构,在推动“脑计划”高新技术研发和成果转化方面发挥了重要作用。例如,科维理基金会作为“脑计划”发起者之一,通过与白宫沟通推进“脑计划”成形、在“脑计划”框架下投资组建神经科学研究所和每年提供约400万美元经费以资助“脑计划”项目等方式,对美国“脑计划”有不容小觑的助推作用。
2.3 建立数据标准和数据共享平台为切实推动多学科交叉和新技术开发,美国“脑计划”重视建立统一标准化的研究数据,以数据标准化、数据可利用化为目标,通过设置“相关数据标准的研究和制定”研究项目(RFA-MH-20-128),制定数据标准,建立可容纳多个研究团队数据的存储架构,以及开发数据分析和可视化软件,最终构建形成“脑计划”的信息架构。美国“脑计划”官网及时分享脑科学最新研究成果,艾伦研究所以brain-map.org网站作为共享平台,向科学家和公众提供人脑数字图谱集;美国“脑计划”资助的大型合作项目细胞普查网络(BICCN)建立了一个全面的大脑细胞类型资源平台[21],可通过分子水平、解剖学和功能学多个维度对外传播和共享鱼、小鼠[22]及人类的大脑细胞数据。此外,美国“脑计划”制定了清晰开放的数据共享机制,包括:来自美国“脑计划”资助项目的数据必须在期刊首次发表时公开分享;数据应以标准格式存储于NIH维护的中央服务器上,数据标准涉及数据收集、使用、储存和访问多个环节;尽可能多地存储原始数据,将成果适当分配给数据采集者等,有效提高了成员单位的协作效率。
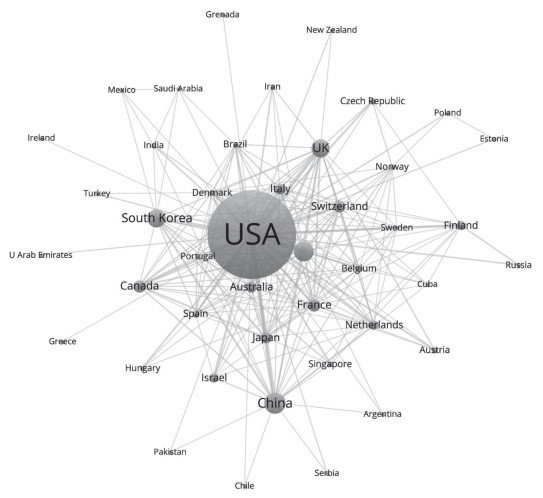
2.4 利用全球资源广泛开展国际合作随着美国“脑计划”研究的不断深入,美国越来越重视国际合作对于知识共享和成果转化的重要作用,继而在多个国家之间开展全球性的项目合作。美国“脑计划”的国际成员包括澳大利亚健康与医学研究委员会、加拿大脑基金会和丹麦灵北脑科学基金会等。美国“脑计划”启动以来,美国与全球多个国家联合发表科研论文,与中国、韩国、德国、英国、以色列和澳大利亚等国家建立了密切的合作关系(图 5)。包括中国科学院北京基因组研究所、清华大学-北京大学生命科学联合中心、郑州大学等多个中国科研机构与美国在神经递质的荧光探针设计、构建轻度认知损害的大脑网络等方向合作发表多篇研究论文。特别在神经联结图谱研究方面,华中科技大学Britton Chance生物医学光子学研究中心骆清铭团队致力于生物医学光子学高速脑成像新技术方法研究,其发明的双光子钙成像方法(如高分辨荧光信号微光学分层成像法HD-fMOST)可实现在单个神经元水平的全脑功能投射成像[23, 24],其获得NIH资助并与美国实验室合作开展了大量研究工作,在小鼠大脑的基本网络(皮质—基底神经节—丘脑—皮质神经环路)[25]、小鼠初级运动皮层的解剖学研究[22]、单个神经元形态多样性与细胞类型定义[26]等方面取得突破性进展。此外,骆清铭团队还参与了美国“脑计划”细胞普查网络(BICCN)项目的研究,对哺乳动物初级运动皮层开展多模式细胞普查并绘制图谱[21]。
|
| 图 5 美国“脑计划”科研论文的国家合作网络 Figure 5 The US BRAIN Initiative's publications based national cooperation network |
美国“脑计划”资助奖项目除分布于美国本土,还有部分位于英国(伦敦大学学院)、法国(皮埃尔和玛丽居里大学、艾克斯-马赛大学)、德国(慕尼黑工业大学、马克斯普朗克神经生物学研究所)、荷兰(乌特勒支大学医学中心)和以色列(以色列特拉维夫大学、耶路撒冷希伯来大学)等①,上述项目利用欧洲大脑研究基础设施EBRAINS提供的开放性的计算工具、模型和数据,整合跨学科的脑科学资源,建立理论框架,加深了对神经认知的理解。
① The BRAIN Initiative. Funded Awards Map. [2023-02-13]. https://braininitiative.nih.gov/funding/funded-awards/map.
3 相关启示2016年4月6日,我国正式批复“科技创新2030—‘脑科学与类脑研究’重大项目”立项。如何把握当前脑科学发展的战略机遇,培育和储备在神经科学和类脑研究尖端科技领域的创新能力,是当前面临的重要挑战。美国“脑计划”的发展模式对我国脑科学研究的创新能力打造和高质量研究成果产出具有一定参考意义。
3.1 紧贴国家战略需求加强顶层设计顶层设计对于大科学计划的顺利实施和成果交付具有举足轻重的作用。NIH提出的整体战略规划报告(BRAIN 2025)和中期战略报告(BRAIN 2.0)对“脑计划”在不同时期的实施进行了战略规划,明确了优先研究领域,并制定了短期和长期规划,形成了规划制定、实施执行、监测评估和更新迭代国家技术战略链条。美国高端智库还推出系列战略报告,如波托马克政策研究所于2013年4月发布的《神经技术未来研究:21世纪引领经济革命的神经科学和技术发展路线图》等,也对美国脑科学发展路线图的形成发挥了重要战略引领作用。
因此,提出以下建议:① 我国脑科学领域的创新发展,应紧贴“健康中国”战略需求,可借鉴美国“脑计划”战略制定、实施和监测的模式,并参考“美国国家科技战略”的实施政策路线图[27],完善符合我国国情的脑科学技术战略框架,进一步提升我国科技项目的顶层设计和系统谋划能力;② 招募多领域跨学科科学家评估我国脑科学相关技术的发展现状,分析发展趋势、机会和挑战等关键要素,并对实现战略目标和优先发展事项提出建议;③ 建立健全可重复、透明的监测和评估程序,将动态评估结果作为新阶段战略修订的依据,循环迭代,以使战略适应技术进步的新趋势。
3.2 注重并大力发展脑科学相关生物原创技术科技创新是制胜未来的决定因素,世界各国围绕脑科技这一制高点的竞争日趋激烈。美国“脑计划”提出以发展创新神经技术工具为首要切入点,包括开发标记、记录和操纵神经元和神经胶质细胞的工具、改进技术,以从多个层次绘制神经环路图、开发用于大规模监测神经活动的方法及可精准改变神经环路动态的干预工具等。其资助的美国“脑计划”细胞图谱网络(BICAN)将可能改变后人进行神经科学研究范式,创新研究成果的转化还将引领神经系统疾病诊疗的新模式。我国也应重视并大力发展脑科学相关生物原创技术。
结合我国当前正处于从技术应用向原始创新的转型发展关键期的基本国情,提出以下建议:① 重视神经科学理论基础研究。建立对脑科学新理论和新概念研究的长期资助机制,还应注重脑科学与信息技术、材料科学的结合发展与迭代,打造脑科学和类脑研究发展新范式,以理论研究创新推进对生物原创技术的培育。② 加强灵长类动物大脑研究。中国具有丰富的灵长类动物资源的天然优势,大力发展适用于灵长类脑研究的新技术和新方法,或利用美国“脑计划”开发的新技术研究灵长类大脑的连接、发育,可能在灵长类脑研究中取得突破性成果[16]。③ 鼓励培育颠覆性技术。应在脑科学和类脑研究领域设置一批概念原创的非主流项目,对有颠覆性潜力的技术实行“概念验证—项目批复—小额启动—持续增资—定期评估”的资助机制。
3.3 紧前部署“脑计划”衍生的科学数据治理研究数字时代的来临使得数据治理成为“大势所趋”,科学数据治理在保障大科学计划的顺利实施过程中发挥着举足轻重的作用。美国“脑计划”设立数据标准制定类的专门研究项目,以促进数据的可用和共享。在数据平台建设方面,我国“脑计划”资助建立了我国人脑健康多维数据库,包括西南大学青少年人脑核磁共振纵向追踪数据库等,但我国在数据共享方面普遍存在所有权不明确、标准不健全和安全风险管控和责任缺乏权威认证等问题[28]。
因此,建议:① 我国“脑计划”在运行初期应尽早开展科学数据治理的顶层设计;② 建立包容性强的数据存储架构,还应设置课题专门研究数据标准的制定和统一问题;③ 建立脑科学数据汇交平台,对所有研究项目提出数据汇交要求,并将项目承研机构是否保质保量地提交研究数据作为项目评估结果的重要考核指标。
3.4 探索战略性政企合作模式政企合作伙伴关系是一种需要政府和产业部门通力合作,以解决共同问题为目标的新型合作模式,在优化资源配置、降低新型技术的研发成本、推动技术转化应用和控制风险方面具有独特优势,已成为一种重要的创新政策工具。美国“脑计划”资助公私合作项目(public-private partnerships)吸引了美国波士顿科学公司和贝莱德微系统公司等美国国内知名尖端科技公司的参与,该项目通过创建合作研究协议和保密协议,简化研究机构与设备制造商开展临床研究的法律和行政审批程序,有力推动了新型神经调制技术和工具的临床转化。我国“脑计划”的参与机构除了中国科学院、中国医学科学院、军事科学院,以及相关高等院校等,近年来民营研究机构也异军突起,发展迅速,如美国国际数据集团(international data group,IDG)麦戈文脑研究院已与国内4家单位联合建立研究院,陈天桥雒芊芊脑科学研究院在上海投资实验室支持脑科学研究,以及上海脑虎科技有限公司、BrainCo强脑科技等初创企业,民营力量在我国“脑计划”框架下的发展空间可进一步扩大。
在以上已有发展基础上,进一步建议:① 完善民营力量的参与机制、成果分配机制和激励机制,简化科研转化的业务审批流程,打通科研转化堵点;② 政府科技主管行政部门通过会商等形式与基金会建立沟通机制,制定小型企业创新培育计划,培育一批尖端技术创新型小企业,使之可为我国“脑计划”实施贡献力量。
3.5 构建跨学科交叉融合研究网络跨学科交叉是取得重大科学发现和产生引领性成果的重要方式,推动跨学科交叉研究是提升原始创新能力的重要途径。美国“脑计划”汇集众多学科领域专家如化学家、物理学家、工程师与神经科学家开展多学科交叉研究,优先资助“整合方法”研究领域,如设置支持以跨学科探索小组的形式开展脑神经回路研究的资助机会类项目(RFA-NS-20-029),极大推动了新技术的开发与应用。此外,在美国“脑计划”框架下,NSF与加拿大健康研究所(CIHS)、德国研究基金会(DFG)等国际机构合作设立全球性神经科学研究项目“下一代神经科学网络”(NeuroNex)项目,将全球跨学科的研究人员聚集到一个网络中,开发创新性、可访问和可共享的技术和方法,以加强对神经和认知研究的理解。
据此建议:① 我国建立跨学科网络可借鉴国际已开展的“大科学研究计划”的设计、组织与实施经验,适时发起以我为主的国际脑科学计划,设置任务导向式整合型项目,汇集全国乃至全球多学科科学家和工程师,从多个层次探索大脑工作原理;② 成立科研管理分支部门,专门管理交叉学科研究,并建立明确的交叉学科研究成果评估机制,包括在评价专家组中设置跨学科研究评审专业,消除专家学科偏倚对我国脑科学项目布局及评估的影响等。
3.6 加强脑科学伦理研究脑科学与神经技术发展引发了覆盖隐私考虑、非人类灵长类动物模型系统的使用、神经调节和增强、受试者参与脑研究和神经科学研究的公平性等诸多神经伦理问题,制定神经伦理学指导框架可为上述问题提供有效的解决方案,确保脑科学研究的高质量开展。美国“脑计划”重视神经伦理学研究,将伦理问题作为关键问题写入战略规划中,BRAIN 2025工作组和BRAIN 2.0工作组均设置神经伦理小组,将神经伦理学引入对人类大脑回路分析的整个过程,负责制定伦理研究项目指南,以及为“脑计划”项目研究人员提供伦理咨询。在美国“脑计划”执行中期,经过神经伦理研讨会广泛收集意见,“脑计划”神经伦理亚组制定了“‘脑计划’与神经伦理:促进神经科学的社会发展”报告,以应对神经调制工具、技术的成熟和人体应用所衍生的一系列备受关注的伦理争议问题。NIH自2017财年开始持续资助神经伦理类项目,研究人类脑科学科技进展相关的核心伦理问题(RFAMH-18-500),解析意识的科学机制和伦理基础。我国学者分析了我国“脑计划”实施过程中存在的隐私、器官捐赠和歧视等社会伦理问题,并提出了“君子和而不同”等与中国传统文化相符的应对策略[29],然而我国“脑计划”的伦理道德框架仍需进一步探索和完善。
因此,建议:① 我国在专家组中成立神经伦理学工作组,制定适应我国传统文化的脑科学研究伦理框架和原则,预判神经和类脑研究相关技术的潜在伦理风险,制定可与脑科学研究实践密切结合的伦理协调管理机制[30];② 积极参与国际神经伦理学对话,为伦理冲突提供更优的解决方案,提升我国科研工作的质量和国际认可度。
| [1] |
Hyun I. Moonshots and other metaphors: The BRAIN Initiative. AJOB Neuroscience, 2020, 11(3): 198-200. DOI:10.1080/21507740.2020.1778131 |
| [2] |
Alivisatos A P, Chun M, Church G M, et al. The brain activity map project and the challenge of functional connectomics. Neuron, 2012, 74(6): 970-974. DOI:10.1016/j.neuron.2012.06.006 |
| [3] |
Ngai J. BRAIN 2.0:Transforming neuroscience. Cell, 2022, 185(1): 4-8. DOI:10.1016/j.cell.2021.11.037 |
| [4] |
Lee T, Cai L X, Lelyveld V S, et al. Molecular-level functional magnetic resonance imaging of dopaminergic signaling. Science, 2014, 344(6183): 533-535. DOI:10.1126/science.1249380 |
| [5] |
Bartelle B B, Barandov A, Jasanoff A. Molecular fMRI. Journal of Neuroscience, 2016, 36(15): 4139-4148. DOI:10.1523/JNEUROSCI.4050-15.2016 |
| [6] |
Smart O, Choi K S, Riva-Posse P, et al. Initial unilateral exposure to deep brain stimulation in treatment-resistant depression patients alters spectral power in the subcallosal cingulate. Frontiers in Computational Neuroscience, 2018. DOI:10.3389/fncom.2018.00043 |
| [7] |
Noecker A M, Choi K S, Riva-Posse P, et al. Stimvision software: Examples and applications in subcallosal cingulate deep brain stimulation for depression. Neuromodulation, 2018, 21(2): 191-196. DOI:10.1111/ner.12625 |
| [8] |
Norman S L, Maresca D, Christopoulos V N, et al. Single-trial decoding of movement intentions using functional ultrasound neuroimaging. Neuron, 2021, 109(9): 1554-1566. DOI:10.1016/j.neuron.2021.03.003 |
| [9] |
Kampasi K, English D F, Seymour J, et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystems & Nanoengineering, 2018, 4(2): 10. |
| [10] |
Sze G, Wintermark M, Law M, et al. Human neuroimaging and the BRAIN Initiative: A joint statement from the ASNR and ASFNR, with the support of the RSNA, ACR, ARR, and ISMRM. American Journal of Neuroradiology, 2014, 35(2): 213-214. |
| [11] |
Yin W, Brittain D, Borseth J, et al. A petascale automated imaging pipeline for mapping neuronal circuits with highthroughput transmission electron microscopy. Nature Communications, 2020, 11(1): 4949. DOI:10.1038/s41467-020-18659-3 |
| [12] |
Sohrabpour A, Cai Z X, Ye S, et al. Noninvasive electromagnetic source imaging of spatiotemporally distributed epileptogenic brain sources. Nature Communications, 2020, 11(1): 1946. DOI:10.1038/s41467-020-15781-0 |
| [13] |
Moreaux L C, Yatsenko D, Sacher W D, et al. Integrated neurophotonics: Toward dense volumetric interrogation of brain circuit activity-at depth and in real time. Neuron, 2020, 108(1): 66-92. DOI:10.1016/j.neuron.2020.09.043 |
| [14] |
Adewole D O, Struzyna L A, Burrell J C, et al. Development of optically controlled "living electrodes" with long-projecting axon tracts for a synaptic brain-machine interface. Science Advances, 2021, 7(4): eaay5347. DOI:10.1126/sciadv.aay5347 |
| [15] |
Struzyna L A, Adewole D O, Gordian-Velez W J, et al. Anatomically inspired three-dimensional micro-tissue engineered neural networks for nervous system reconstruction, modulation, and modeling. Jove-journal of Visualized Experiments., 2017, 123: e55609. |
| [16] |
鲁白. 美国"脑计划"借鉴. 中国经济报告, 2017, (4): 111-114. Lu B. Lessons learned from the US BRAIN Initiative. China Economic Report, 2017, (4): 111-114. (in Chinese) |
| [17] |
Farrar M J, Kolkman K E, Fetcho J R. Features of the structure, development, and activity of the zebrafish noradrenergic system explored in new CRISPR transgenic lines. Journal of Comparative Neurology, 2018, 526(15): 2493-2508. DOI:10.1002/cne.24508 |
| [18] |
Raj B, Gagnon J A, Schier A F. Large-scale reconstruction of cell lineages using single-cell readout of transcriptomes and CRISPR-Cas9 barcodes by scGESTALT. Nature Protocols, 2018, 13(11): 2685-2713. DOI:10.1038/s41596-018-0058-x |
| [19] |
Zhang L Y, Lin P, Pan J, et al. Clarity for high-resolution imaging and quantification of vasculature in the whole mouse brain. Aging and Disease, 2018, 9(2): 262-272. DOI:10.14336/AD.2017.0613 |
| [20] |
Chung K, Wallace J, Kim S Y, et al. Structural and molecular interrogation of intact biological systems. Nature, 2013, 497(7449): 332-337. DOI:10.1038/nature12107 |
| [21] |
Callaway E M, Dong H W, Ecker, J R, et al. A multimodal cell census and atlas of the mammalian primary motor cortex. Nature, 2021, 598(7879): 86-102. DOI:10.1038/s41586-021-03950-0 |
| [22] |
Munoz-Castaneda R, Zingg B, Matho K S, et al. Cellular anatomy of the mouse primary motor cortex. Nature, 2021, 598(7879): 159-166. DOI:10.1038/s41586-021-03970-w |
| [23] |
Zhou W, Ke S S, Li W W, et al. Mapping the function of whole-brain projection at the single neuron level. Advanced Science, 2022, 9(33): 2202553. DOI:10.1002/advs.202202553 |
| [24] |
Gao L, Liu S, Gou L, et al. Single-neuron projectome of mouse prefrontal cortex. Natrue Neuroscience, 2022, 25(4): 515-529. DOI:10.1038/s41593-022-01041-5 |
| [25] |
Foster N N, Barry J, Korobkova L, et al. The mouse corticobasal ganglia-thalamic network. Nature, 2021, 598(7879): 188-194. DOI:10.1038/s41586-021-03993-3 |
| [26] |
Peng H, Xie P, Liu L, et al. Morphological diversity of single neurons in molecularly defined cell types. Nature, 2021, 598(7879): 174-181. DOI:10.1038/s41586-021-03941-1 |
| [27] |
唐璐, 张志强. 新美国安全中心"美国国家技术战略"报告剖析及启示. 图书与情报, 20221, (1): 49-56. Tang L, Zhang Z Q.. The U. S. national technology strategy reports and enlightenment to Chinese S&T think tanks. Library and Information, 20221, (1): 49-56. (in Chinese) |
| [28] |
兰蓝, 李瑞, 白波, 等. 医疗机构数据共享关键问题研究与数据治理对策. 中国卫生信息管理杂志, 2022, 19(2): 184-188. Lan L, Li R, Bai B, et al. Research on key issues of data sharing in medical institutions and countermeasures of data governance. Chinese Journal of Health Informatics and Management, 2022, 19(2): 184-188. (in Chinese) |
| [29] |
Wang Y, Yin J, Wang G, et al. Responsibility and sustainability in brain science, technology, and neuroethics in China-a culture-oriented perspective. Neuron, 2019, 101(3): 375-379. DOI:10.1016/j.neuron.2019.01.023 |
| [30] |
樊天, 樊春良. 负责任研究与创新框架之下的脑科学伦理治理-对欧盟脑科学计划(HBP)的案例研究. (2022-08-18)[2023-03-15]. https://kns.cnki.net/kcms/detail/11.1805.G3.20220817.1405.002.html. Fan T, Fan C L. Ethical governance in brain science under the framework of responsible research and innovation-A case study of the European Union Brain Science Program (HBP). (2022-08-18)[2023-03-15]. https://kns.cnki.net/kcms/detail/11.1805.G3.20220817.1405.002.html. (in Chinese) |





